Расчеты в гравиметрическом анализе
Расчет массы навески. Масса навески зависит от характера осадка (осаждаемой формы), а также от содержания осаждаемого элемента в анализируемой пробе. Оптимальная масса осадка - весовой формы - для кристаллического осадка составляет 0,4-0,5 г, для аморфного - около 0,1-0,2 г. Если осадок с трудом поддается прокаливанию, масса его должна составлять около 0,1 г.
Пример 1. Требуется определить содержание Ca в известняке, который состоит в основном из карбоната кальция CaCO3. Осаждают кальций оксалатом аммония (NH4)2C2O4 в виде оксалата кальция. CaC2O4 - осадок кристаллический, весовая форма - оксид кальция CaO, масса весовой формы примерно 0,5 г. Найти массу навески.
Реакции протекают по уравнениям
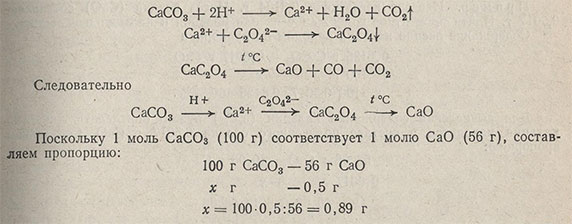
Масса навески должна быть около 0,9 г.
Пример 2. Требуется определить содержание железа в железоаммонийных квасцах. Осаждают железо аммиаком в виде гидроксида. Fe(OH)3 - осадок аморфный, весовая форма - оксид железа Fe2O3, масса весовой формы примерно 0,1 г. Найти массу навески. Реакции протекают по уравнениям
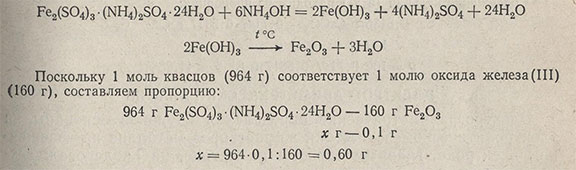
Масса навески должна быть около 0,6 г.
Пример 3. Найти массу навески стали, необходимой для определения содержания никеля в стали. Содержание никеля составляет около 5%. Осаждают никель диметилглиоксимом. Весовая форма - диметилглиоксимат никеля. При фильтровании через стеклянный фильтрующий тигель масса осадка должна составлять примерно 0,2 г. Реакция протекает по уравнению
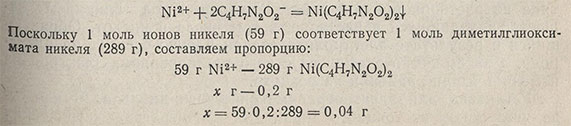
При содержании никеля 5% навеска стали должна составлять
100 : 5 = у : 0,04
у = 100 * 0,04 : 5 = 0,8 г
Вычисление содержания вещества (в %). Для вычисления содержания вещества (в %) нужно знать массу навески, массу полученного осадка (весовой формы) и его химическую формулу. Вычисления ведут по соответствующим пропорциям.

