Методы комплексометрии
Основаны на образовании устойчивых комплексных соединений ионов металлов с органическими реактивами (например, с ЭДТА). ЭДТА - динатриевая соль этилендиаминтетрауксусной кислоты (ранее называемый комплексон III или трилон Б) содержит в своем составе карбоксильные группы (COOH-) и третичный азот. Может образовывать с рядом катионов прочные растворимые в воде внутрикомплексные соединения.
Установление точки эквивалентности. Для прямого титрования катионов применяют специальные индикаторы - органические красители, образующие с катионами окрашенные комплексные соединения, которые менее прочны, чем соединения этих катионов с ЭДТА.
Перед титрованием к раствору соли металла добавляют индикатор, при этом образуется определенной окраски комплекс с металлом. Затем раствор титруют ЭДТА и индикатор вытесняется из его комплекса с катионом. В точке эквивалентности катионы полностью связываются ЭДТА, а индикатор полностью высвобождается. Поскольку свободный индикатор имеет иной цвет, чем в комплексе с катионом, в точке эквивалентности происходит изменение окраски.
Рассмотрим два комплексометрических индикатора.
Мурексид (пурпурат аммония). Порошок темно-красного цвета, малорастворимый в воде. Водные растворы неустойчивы. Для применения растирают в ступке сухую смесь индикатора с хлоридом натрия в соотношении 1:100. Для титрования добавляют в колбу 20-30 мл смеси. Переход окраски от красной к сине-фиолетовой (при определении Ca2+).
Эриохром черный Т. Черный порошок; применяют для определения многих катионов при различных значениях pH. Готовят сухую смесь в соотношении 1:100 с хлоридом или сульфатом натрия. Смесь следует хранить в склянке из темного стекла с притертой пробкой; смесь пригодна к работе 10-12 месяцев. Без смешивания с солью-заполнителем индикатор применять нельзя, так как окраска будет слишком интенсивной. Переход окраски от винно-красной к синей.
Буферные смеси. Поскольку многие металлиндикаторы являются одновременно pH-индикаторами и изменяют свою окраску при изменении концентрации ионов H+, перед титрованием необходимо устанавливать определенное значение pH. Так как во время титрования концентрация ионов H+ повышается, для сохранения постоянного значения pH следует применять соответствующую буферную смесь.
Приводим состав некоторых буферных смесей.

Приготовление 0,05 М раствора ЭДТА. Концентрацию растворов ЭДТА выражают через молярность. Молекулярная масса ЭДТА составляет 372,24. Навеску ЭДТА (18,6 г на 1 л 0,05 М раствора) растворяют в 400-500 мл воды. Если раствор мутный, его фильтруют и разбавляют водой до 1 л. Из очищенного перекристаллизацией (или из фиксанала) можно готовить раствор по точной навеске, растворяя ее в воде в мерной колбе вместимостью 1 л. Приготовленный раствор ЭДТА следует хранить в обработанной пропариванием склянке из иенского стекла. Из обычного стекла при длительном хранении выщелачиваются заметные количества ионов Ca2+, что ведет к изменению титра раствора.
Установление молярности раствора. Молярность устанавливают по карбонату кальция (хч или чда), высушенному при 80-100 °С до постоянной массы. Переводят 5,0045 г реактива в мерную колбу вместимостью 1 л и прибавляют 30 мл разбавленной (1:1) HCl. После полного растворения навески раствор разбавляют водой до метки.
Отбирают 25,0 мл приготовленного 0,05 М раствора хлорида кальция в колбу для титрования, добавляют воды до 100 мл и 20%-ный раствор едкого натра или едкого кали до установления pH = 12-12,5, затем на кончике шпателя 0,1-0,2 г смеси мурексида с хлоридом натрия (1:100); окрашенный в розовый цвет раствор титруют 0,05 М раствором ЭДТА до отчетливого перехода окраски к лиловой (аметистовой). Значение рН = 12-12,5 контролируют по индигокарминовой бумаге до появления желтого окрашивания.
Установить молярность можно по металлическому цинку. Для этого готовят 0,05 М раствор хлорида цинка. Навеску 3,2690 г электролитического цинка (можно гранулированного, без мышьяка) растворяют в 20-30 мл разбавленной (1:1) HCl при слабом нагревании. Раствор переводят в мерную колбу вместимостью 1 л и разбавляют водой.
Отбирают 25,0 мл приготовленного 0,05 М раствора хлорида цинка в коническую колбу для титрования вместимостью 250 мл, добавляют воды 50 мл, нейтрализуют избыток кислоты раствором аммиака (1:1), прибавляют 10 мл буферного раствора с pH = 10 (приготовление см. выше), индикатора эриохром черного Т (1%-ная смесь с хлоридом натрия) на кончике шпателя и титруют 0,05 М раствором ЭДТА до перехода окраски от винно-красной в синюю.
При вычислении титра раствора ЭДТА по определяемым элементам необходимо учитывать, что ионы двух-, трех- и четырехвалентных элементов взаимодействуют с ЭДТА в молярном отношении 1:1. Эквивалент любого металла равен его атомной массе независимо от валентности.
Способы комплексометрических титрований
Прямое титрование. Многие ионы металлов титруют раствором ЭДТА в щелочной среде с применением соответствующих металлиндикаторов. При титровании вводят в раствор аммиачные буферные смеси (рН = 8-10) или растворы щелочи (рН = 12). Для предупреждения выпадения гидроксидов металлов (которые не подлежат титрованию) добавляют вспомогательные комплексообразователи (тартраты, цитраты и т.п.). Раствор должен обладать достаточной буферной емкостью, чтобы pH его не изменялся от высвобождающихся при титровании ионов H+. Прямым титрованием определяют ионы Ba2+, Ca2+, Cu2+, Co2+, Mg2+, Mn2+, Cd2+, Ni2+, Pb2+, Sr2+, Zn2+, Fe3+, Th4+, Ga4+, TiO22+ и др. Конец титрования определяют по изменению окраски индикатора.
Обратное титрование. В тех случаях, когда прямое титрование по тем или иным причинам невозможно, применяют обратное титрование. К анализируемому раствору добавляют в избытке точно измеренный объем стандартного раствора ЭДТА, затем оттитровывают его избыток стандартным раствором хлорида (или сульфата) цинка, магния или определяемого катиона в присутствии соответствующего металл-индикатора. Методом обратного титрования определяют катионы, для прямого титрования которых нет подходящих индикаторов. Определяют также содержание катионов в нерастворимых в воде осадках (Ca2+ в CaCO3, Mg2+ в MgNH4PO4, Pb2+ в PbSO4).
Титрование заместителя (заместительное титрование). Метод титрования заместителя основан на том, что ионы Mg2+ дают с ЭДТА менее устойчивое комплексное соединение, чем многие другие ионы. Поэтому при смешивании определяемого катиона с магниевым комплексом ЭДТА происходит реакция двойного обмена. Например:
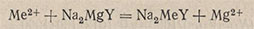
Поскольку ионы металла Me2+ образуют с ЭДТА более устойчивое комплексное соединение, чем ионы Mg2+, то высвободившийся в эквивалентном количестве магний-ион оттитровывают раствором ЭДТА, как обычно с соответствующим индикатором. Расход раствора ЭДТА, затраченного на титрование иона Mg2+, соответствует количеству определяемого иона, как и при прямом титровании.
