Полярографический анализ
К электрохимическим методам анализа относится также полярографический анализ, основанный на измерении силы тока, возникающего при электровосстановлении или электроокислении анализируемого вещества на микроэлектроде.
Полярографический метод анализа обладает высокой чувствительностью, что позволяет проводить определение очень малых количеств исследуемого вещества. Рекомендуемый интервал определяемой концентрации составляет 10-3-10-4 моль/л, минимально допустимая определяемая концентрация может достигать 10~6 моль/л. Полярография дает возможность одновременно вести определение нескольких веществ, не прибегая к предварительному их разделению. Время определения обычно не превышает нескольких минут.
Если к электродам, опущенным в раствор электролита, приложить разность потенциалов и постепенно ее увеличивать, то при слишком малой разности потенциалов ток практически не будет протекать через раствор. При достижении разности потенциалов определенной величины (потенциал разложения) сила тока резко возрастает.
При полярографических определениях о ходе электролиза исследуемого вещества судят одновременно по силе тока в цепи и по приложенному напряжению. Полученная вольт-амперная характеристика (рис. 19) используется как для идентификации вещества, так и для определения его концентрации.
Если взять один из электродов с малой поверхностью (обычно применяют капельный ртутный катод), а другой - с большой поверхностью, то при пропускании через раствор постоянного тока основное изменение концентрации будет наблюдаться у электрода с малой поверхностью. Это объясняется большой плотностью тока на микроэлектроде. Для правильной интерпретации вольт-амперной кривой необходимо, чтобы процессом, лимитирующим скорость электролиза, была диффузия анализируемого электроактивного вещества к электроду. В полярографии движение определяемых ионов сводится к минимуму за счет добавления большого избытка (50-100-кратного) индифферентного электролита, называемого фоном. Поскольку концентрация определяемого электроактивного вещества мала по сравнению с концентрацией фона, то практически весь ток определяется движением ионов фона.
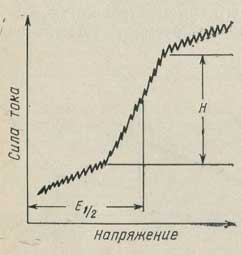
Рис. 19. Полярографическая (вольт-амперная) кривая.
E1/2 - потенциал полуволны; H - высота полярографической волны.
Постепенное повышение напряжения приводит к возрастанию плотности тока на микроэлектроде. При этом концентрация электроактивного вещества в приэлектродном пространстве становится меньше его концентрации в основной массе раствора, так как скорость его восстановления (или окисления) на микроэлектроде становится больше скорости диффузии его из раствора. В этом случае дальнейшее повышение разности потенциалов не вызывает заметного возрастания силы тока, протекающего через раствор (предельный ток). Если скорость процесса в электролитической ячейке контролируется диффузией, то сила тока пропорциональна концентрации электроактивного вещества. Таким образом, при потенциале разложения только часть ионов, достигающих электрода, разряжается на его поверхности. При потенциале полуволны на электроде разряжается половина ионов, достигающих его поверхности. И, наконец, предельный ток пропорционален концентрации определяемых ионов в массе раствора.
Диффузионный ток равен разности между предельным током и остаточным током. Он прямо пропорционален концентрации вещества в растворе. Таким образом, высота волны Н характеризует диффузионный ток и дает возможность определить концентрацию анализируемого вещества.
Потенциал, соответствующий току, который равен половине диффузионного тока, называется потенциалом полуволны. Он зависит не от концентрации вещества, а от природы восстанавливаемого (или окисляемого) иона. Потенциал полуволны является важной характеристикой вещества и может служить для его идентификации.
Электрод, на котором происходит аналитическая электрохимическая реакция, должен быть поляризован. Чтобы добиться поляризации, необходимо использовать электрод с малой поверхностью. Применение металлического, неподвижно закрепленного электрода не приводит к хорошим результатам, так как толщина диффузионного слоя у электрода будет меняться (увеличиваться), а это приведет в свою очередь к уменьшению предельного тока. Чтобы избежать этого явления, можно использовать быстро вращающийся платиновый микроэлектрод. В этом случае диффузионные слои на поверхности раздела фаз сохраняют постоянную малую толщину. Но образующийся на поверхности электрода осадок металла быстро меняет природу электрода. Поэтому платиновый вращающийся электрод чаще используют не при восстановительной, а при окислительной полярографии.
При обычной восстановительной полярографии чаще всего используется капающий ртутный электрод, состоящий из тонкого капилляра, через который медленно (1 капля в 3-5 с) капает ртуть из расположенного выше резервуара. Период образования капли можно менять, изменяя высоту расположения резервуара с ртутью над капилляром. Таким образом, электрод обновляется каждые 3-5 с и процесс переноса электронов на каждой следующей капле начинается в условиях, когда ртуть имеет чистую поверхность. Поскольку размер ртутной капли меняется за время ее жизни от нуля до максимального в момент отрыва, то и сила тока будет колебаться от минимального до максимального значения и вольт-амперная кривая будет иметь вид, изображенный на рис. 18. Степень осцилляции силы тока в цепи уменьшают введением емкостей и демпфированных гальванометров; измеряемая средняя сила тока (усредненная по времени жизни капли) равна 6h от максимальной силы тока в момент перед падением капли.
Серьезным недостатком капающего ртутного электрода является его сравнительно легкая окисляемость. Поэтому его не рекомендуется использовать в качестве анода. В этом случае предпочтительнее микродисковый платиновый вращающийся электрод.
В качестве второго электрода (с большой поверхностью) используют стандартный насыщенный каломельный электрод или ртуть, налитую на дно электролитической ячейки.
Приборы для полярографического анализа называются полярографами. Современные полярографы - сложные регистрирующие приборы, обеспечивающие высокую точность определений (погрешность 1-2%). График зависимости силы тока от потенциала капающего электрода называется полярограммой. Если в растворе присутствует несколько восстанавливаемых соединений, то полярограмма имеет вид многоступенчатой кривой. В этом случае положение потенциалов полуволн и значения силы тока соответствует величинам, полученным для растворов индивидуальных соединений с той же концентрацией определяемого вещества.
Для удаления кислорода из анализируемого раствора рекомендуется перед снятием полярограммы продуть его азотом или другим инертным газом. Легкость полярографического восстановления во многих случаях зависит от величины рН раствора, поэтому для получения сравнимых результатов следует проводить измерения при определенной и одинаковой во всех анализах кислотности раствора.
Ход определения и методика работы на приборе подробно излагаются в инструкции к нему, однако суть их заключается в следующем. Анализируемый раствор помещают в электролизер. Температура полярографической ячейки должна быть постоянной, в пределах +-0,5 С. Для удаления кислорода в испытуемом растворе пропускают через него в течение 10-15 мин азот или водород. Активный кислород можно связать и химическими реактивами - сульфитом натрия и др.
Ртутный капельный электрод помещают в раствор. При этом регулируют скорость падения капель ртути и снимают полярограмму в области указанного потенциала. Затем в тех же условиях получают полярографическую волну стандартного образца. Высоту волны находят графически и измеряют в миллиметрах. Концентрацию испытуемого раствора можно найти методом калибровочных кривых или методом стандартных растворов, или методом добавок.
При использовании метода калибровочных кривых готовят ряд растворов с различной концентрацией стандартного образца, снимают их полярограммы и определяют высоту волн. По полученным данным строят калибровочный график высота волны - концентрация. Затем снимают полярограмму исследуемого раствора, находят высоту волны и, пользуясь калибровочным графиком, определяют искомую концентрацию. Метод калибровочных кривых наиболее целесообразно применять при проведении большого числа однотипных, серийных анализов.
Метод стандартных растворов используют в тех случаях, когда известна приблизительная концентрация испытуемого вещества. Вместо серии растворов применяют раствор стандартного образца, концентрация которого достаточно близка к концентрации исследуемого раствора.
Концентрацию вещества (Сх) вычисляют по формуле:
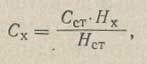
где Сст - концентрация раствора стандартного образца, мг/мл; Hх - высота волны анализируемого раствора, мм; Hст - высота волны раствора стандартного образца, мм.
Метод добавок заключается в том, что объем испытуемого раствора Vx полярографируют и измеряют высоту волны Hх, соответствующую концентрации Сх. Затем приливают к анализируемому раствору отмеренный объем Vст стандартного раствора определяемого вещества. Снова полярографируют и измеряют суммарную высоту волны HE = Нх + Нст. Отсюда легко вычислить высоту волны, соответствующую добавленному количеству определяемого вещества: Hст = HE - Hх. Если учесть, что добавленный стандартный раствор разбавился при смешении с анализируемым в
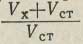
раз, то концентрацию вещества в основном анализируемом растворе следует вычислять по формуле:
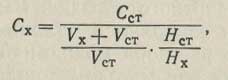
Полярографически определяются многие неорганические катионы (например, металлов), анионы (йодат-, бромат-, нитрат-, перманганат-ионы) и молекулы (кислород, двуокись серы, окись азота, перекись водорода и т. п.). К органическим веществам, которые восстанавливаются на капающем ртутном электроде, относятся соединения, содержащие карбонильные группы, двойные углерод-углеродные связи, связи углерод - галоген, азот - кислород, сера - сера и др. В качестве растворителей часто используют органические жидкости, так как многие из анализируемых этим методом веществ нерастворимы в воде. Многие органические вещества легко окисляются на аноде и дают анодные волны, что также используется для их полярографического определения.
