Определение и анализ функциональных групп органических соединений
Анализ органических веществ во многом отличается от анализа неорганических веществ. Так, качественный анализ неорганических веществ основан на реакциях ионов и цель его - открытие ионов, входящих в состав данного вещества. Свойства органического соединения зависят не только от его элементного состава, но и от наличия и положения функциональных групп. Определение этих групп является важной задачей исследования органических соединений. Химические методы определения органических соединений основаны на реакциях их функциональных групп. Например, для качественного и количественного определения спиртов используют реакции, характерные для спиртовой группы, для определения альдегидов, кетонов, аминов - реакции, характерные для групп: -СНО, -СО, -NH2 и т.п.
Определение первичной аминогруппы методом диазотирования (нитритометрия)
Метод основан на реакции диазотирования первичных аминов.

Точную навеску препарата (около 0,001 г/моль) растворяют в 20 мл разбавленной соляной кислоты и доводят объем водой до 80 мл. Добавляют 1 г бромида калия и титруют при постоянном перемешивании 0,1 и. раствором нитрита натрия, добавляя его в начале титрования по 2 мл в минуту, а в конце - по 0,05 мл в минуту. Конец титрования определяют по устойчивому окрашиванию йодкрахмальной бумаги.
Определение нитрогруппы и нитрозогруппы
Для количественного анализа нитросоединений применяют метод восстановления их хлоридом титана(III) - TiCl3, хлоридом олова (II) - SnCl2 или цинком с последующим диазотированием аминосоединения.
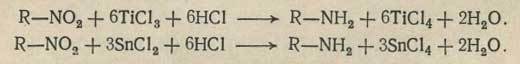
О количестве определяемого нитросоединения судят по расходу титрованных растворов TiCl3 или SnCl2.
Восстановление нитросоединений в соответствующие амины цинковой пылью проводят в солянокислой или уксуснокислой среде. Полученные аминосоединения титруют раствором нитрита натрия:
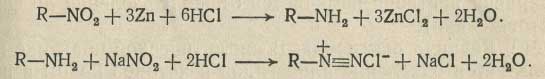
Этот метод используют также для количественного анализа веществ, содержащих нитрозогруппы.
Определение альдегидной и кетонной групп
Для количественных определений альдегидов и кетонов применяют методы, основанные на реакциях присоединения с образованием бисульфитных соединений под действием сульфита натрия; замещения с образованием альдоксимов и кетоксимов при действии солянокислого гидроксиламина; окисления альдегидов и кетонов.
а) Реакция присоединения. Реакцию образования бисульфитного соединения осуществляют с раствором сульфита или бисульфита натрия:

Выделившееся в результате реакции эквивалентное количество щелочи определяется титрованием соляной кислотой. Этот метод применяется для определения формальдегида.
б) Реакция замещения. Для альдегидов и кетонов характерна реакция замещения кислорода карбонильной группы на радикал =N-ОН. В результате реакции образуются альдоксимы и кетоксимы. В качестве рабочего раствора используют спиртовые или водные растворы солянокислого гидроксиламина (NH2OH-HCl) или сернокислого гидроксиламина (NH2OH)2-H2SO4.
При действии солей гидроксиламина на карбонильные соединения происходит образование оксима с выделением эквивалентного количества кислоты (соляной или серной):
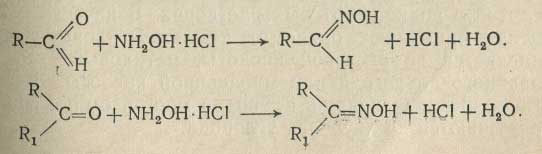
Выделившуюся после реакции кислоту титруют щелочью; индикатор - раствор бромфенолового синего (окраска раствора изменяется от желто-зеленой до фиолетово-синей).
в) Реакция окисления. В аналитической практике используется окисление альдегидов и кетонов йодом в щелочной среде:
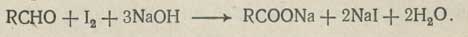
Йод добавляют в избытке, а затем избыток его оттитровывают тиосульфатом натрия.
Окисление кетонов протекает значительно труднее, чем альдегидов. При этом разрывается связь одного из алкилов с карбонильной группой и образуется кислота с меньшим содержанием атомов углерода в молекуле. В щелочной среде реакция протекает по уравнению:
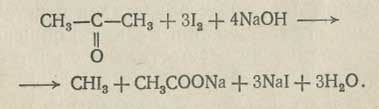
Определение гидроксильной группы в спиртах
Количественный анализ спиртов проводят физическими и химическими методами. Физическими методами определяют плотность спиртов, температуру кипения и объем отгона в заданном температурном интервале. У некоторых спиртов (этиленгликоль, глицерин) измеряют показатель преломления.
Химические методы определения спиртов основаны на реакциях окисления и этерификации. Содержание непредельных спиртов в растворе определяют бромированием. Метод окисления может быть применен только при отсутствии посторонних восстановителей. Этим методом анализируют изопропиловый спирт, глицерин, а также определяют содержание этилового и метилового спиртов в водно-спиртовых растворах. В качестве окислителя применяют бихромат калия. Этиловый спирт окисляется до уксусной кислоты, метиловый - до муравьиного альдегида или муравьиной кислоты. Вторичные спирты переходят в кетоны, а многоатомные спирты разрушаются до двуокиси углерода.
Реакцию этерификации применяют для определения содержания спиртов алифатического ряда. В качестве ацилирующего агента обычно используют уксусный ангидрид в среде пиридина.

При добавлении воды C5H5N-CH3COOH гидролизуется с образованием свободной уксусной кислоты, которую титруют щелочью в присутствии фенолфталеина.
Определение ацетильной группы
Ацетильная группа входит в состав многих лекарственных веществ и промежуточных продуктов их синтеза, поэтому определение содержания вещества по ацетильной группе является распространенным методом технического анализа.
Для определения ацетильной группы пользуются тем же прибором, что и для определения азота при элементном анализе (см. рис. 16). Однако в этом случае приемник соединяют с холодильником через пробку, в которую вставлена также трубка с натронной известью для предохранения отгонов от действия углекислоты воздуха.
В колбу Кьельдаля помещают точную навеску анализируемого препарата, которую в случае необходимости предварительно омыляют щелочью. Объем жидкости в колбе доводят водой до 50-60 мл. Одновременно в парообразователь наливают дистиллированную воду и кипятят ее не менее часа для полного освобождения от углекислоты. После этого реакционную колбу присоединяют к прибору и прибавляют в нее через капельную воронку фосфорную кислоту в количестве, на 5 мл большем, чем нужно для нейтрализации щелочи. Затем отгоняют с паром уксусную кислоту, поддерживая постоянным уровень в реакционной колбе. Процесс продолжают до получения отгона нейтральной реакции. Отогнанную уксусную кислоту титруют 0,1 н. раствором едкого натра; индикатор - фенолфталеин. Параллельно проводят контрольный опыт.
1 мл 0,1 н. раствора едкого натра соответствует 0,006055 г уксусной кислоты или 0,004305 г ацетила (СН3СО).
Определение галогенов
Для определения галогенов в молекуле органического соединения применяется метод сжигания в атмосфере кислорода. (Этот же метод применим и для определения содержания фосфора, серы, селена и некоторых других элементов.)
Определение проводят в колбе из термостойкого стекла со шлифом. В пробку колбы впаяна платиновая проволока, заканчивающаяся платиновой спиралью, расположенной при закрытой пробке в 1,5-2 см от дна колбы.
Точную навеску вещества (обычно около 0,05 г) заворачивают в кусочек беззольной фильтровальной бумаги, оставляя торчащую вверх узкую полоску бумаги. Этот пакетик помещают в платиновую спираль. При анализе жидкостей или мазеобразных веществ их помещают в капсулы из нитропленки или метилцеллюлозы. Капсулы также заворачивают в беззольную фильтровальную бумагу, оставляя узкую полоску. В колбу для сжигания наливают воду или другую поглощающую жидкость (при определении хлора и брома - перекись водорода, при определении йода - раствор едкого натра). Уровень жидкости должен быть ниже спирали. Через колбу пропускают в течение 3-5 мин кислород, затем поджигают свободный конец узкой полоски фильтровальной бумаги и быстро плотно закрывают колбу пробкой (шлиф должен быть смочен водой).
По окончании сжигания тщательно перемешивают содержимое колбы и через 30-60 мин производят определение продуктов сгорания методом, подходящим для данного элемента (например, йод титруют раствором тиосульфата натрия).
