Электропитание и измерение электрических величин
Для питания измерительных схем и приборов необходимы источники стабилизированного постоянного и переменного тока, которые должны удовлетворять различным требованиям в отношении выходного напряжения, мощности, стабильности и др. В большинстве химических лабораторий постоянный ток получают путем выпрямления переменного тока сети и с помощью автономных источников питания - химических источников тока.
Источники питания
Сетевые источники тока
Напряжение переменного тока промышленной частоты (50 Гц), подводимого в лабораторию, может быть 127, 220 и 380 В. Индикацию напряжения можно выполнить сигнальной неоновой лампочкой, свечение которой зависит от напряжения тока. Так, порог зажигания неонового индикатора МИН-1 составляет 90 В; верхний предел индикации 500 В.
Электроэнергия, поступающая из сети переменного тока, стабилизируется, трансформируется до необходимой величины напряжения и выпрямляется.
Для стабилизации напряжения переменного тока большей частью используют электромагнитные и феррорезонансные стабилизаторы. Например, для поддержания неизменным переменного напряжения на входных зажимах приемников энергии часто пользуются электромагнитными стабилизаторами типа С-0,09 и С-0,16 с номинальной мощностью 0,09 и 0,16 кВт соответственно. Напряжение стабилизированного тока 127 ±5 В; ток нагрузки 0,71-0,73 А.
Для питания цепей электроизмерительных приборов и установок можно применять стабилизатор переменного напряжения П71М, особенно в случаях, когда необходимо иметь высокостабильное напряжение. Номинальное стабилизированное напряжение 220 В; ток нагрузки 1,7 А.
Стабилизатор переменного напряжения СЭМ-1 используется для питания источников света в оптико-механических приборах. Напряжение стабилизированного тока 220 + 2 В.
Если требуются низкие напряжения при малых токах, необходимое понижение сетевого переменного напряжения осуществляют с помощью лабораторных трансформаторов.
Наиболее простой способ получения постоянного тока - преобразование переменного тока с помощью выпрямителей. Последние все больше вытесняют электромашинные преобразователи переменного тока в постоянный.
Основной элемент выпрямителей - электрический вентиль, по типам которых выпрямители разделяют на электронные (кенотронные) и полупроводниковые. Наибольшее распространение получили полупроводниковые выпрямители (селеновые, кремниевые и германиевые).
Полупроводниковые выпрямители, в особенности селеновые, обладают рядом преимуществ и чаще других используются в химических лабораториях при относительно больших токах нагрузки и относительно малых напряжениях.
В качестве примера приводим данные о селеновом выпрямителе типа ВСА-А10, который используется для зарядки аккумуляторных батарей напряжением 6 и 12 В, емкостью до 135 А-ч. Выпрямитель может быть также использован как источник постоянного тока для работы на активную нагрузку. Питание от сети переменного тока 127/220 В.
Напряжение (соответственно ток), снимаемое с сетевого выпрямителя, должно быть постоянным и не зависимым от отбираемой мощности и от колебаний сетевого напряжения. В известной мере этим требованиям отвечают стабилизатор напряжения постоянного тока П136М2 и источник калиброванного напряжения П137. Последний прибор предназначен для питания цепей электроизмерительных приборов, а также для измерения постоянного тока в диапазоне 2-300 В.
Выпускаемые стабилизированные выпрямители постоянного тока типа ВС и ВСП обеспечивают выходное напряжение 3-200 В, с максимальным током нагрузки 0,2-10 А.
В лабораторной практике находят применение разнообразные устройства для зарядки аккумуляторов, которые могут быть использованы и как источники стабилизированного постоянного тока для работы на активную нагрузку, например выпрямитель зарядный В31-5А и малогабаритный универсальный выпрямитель ВЗУ.
В последние годы появилось большое число унифицированных блоков питания, которые используют в качестве составных частей (сублоков) устройств электропитания приборов стабилизированным постоянным током. Каждый блок питания состоит из функциональных узлов: выпрямителя с фильтром, стабилизатора напряжения и узла зашиты от короткого замыкания (для блоков с выходным напряжением 27 и 50 В).
Одним из таких блоков питания является модель 2БП2. Напряжение питающей сети переменного тока 380/220 В. Номинальное выходное стабилизированное напряжение постоянного тока 6,3; 10 и 27 В. Номинальный ток нагрузки 4 и 2 А.
Химические источники тока
Химическими источниками тока называют устройства, с помощью которых свободная энергия пространственно разделенных окислительно-восстановительных реакций превращается в электрическую энергию.
Процесс превращения химической энергии в электрическую в химическом источнике тока называется разрядом. Химические источники тока, используемые в лабораторной практике, по характеру работы делятся на две группы: гальванические элементы и аккумуляторы.
К гальваническим элементам, группе первичных химических источников тока, относятся все устройства, которые допускают лишь однократное использование заключенных в них активных веществ, принимающих участие в токообразующих электрохимических процессах; их разряд (отдача электрической энергии) может быть осуществлен в один или несколько приемов. Полностью разряженный гальванический элемент к дальнейшей работе не пригоден. Гальванические элементы бывают с жидким электролитом и сухие, содержащие невыливающийся электролит.
Химические источники тока, работоспособность которых после их разряда может быть восстановлена путем заряда, т.е. пропусканием постоянного тока в направлении, обратном направлению тока при разряде, называют аккумуляторами. В отличие от гальванических элементов, аккумулятор сам энергию не производит, он ее накапливает при заряде (электрическая энергия превращается в химическую) и отдает при разряде (химическая энергия превращается в электрическую). Электрод, который при разряде аккумулятора был анодом, при заряде становится катодом.

Совокупность веществ, участвующих в токообразующей реакции, называется электрохимической системой. Химические источники тока делятся на типы в зависимости от электрохимической системы. Электрохимическая система источников тока имеет свое условное обозначение (табл. 16). В этом обозначении между двумя вертикальными черточками пишется формула электролита, а слева и справа - формулы активных веществ, принимающих участие в токообразующих процессах.
Работа химических источников тока характеризуется рядом параметров, которые зависят от электрохимической системы и конструкции (табл. 17).

Практически химический источник тока перестает работать до того, как полностью израсходовались активные вещества. Часть их расходуется на бесполезные процессы, которые называют саморазрядом. Процесс саморазряда сопровождается выделением газообразных водорода или кислорода.
Конструктивное исполнение химических источников тока может быть самым различным, но все они состоят из двух электродов, разделенных слоем электролита (жидкого или загущенного).
Химические источники тока можно соединять последовательно, когда требуется получать высокое напряжение, и параллельно, когда необходимо иметь большой ток. Для повышения напряжения или емкости (продолжительности работы) или того и другого одновременно, элементы и аккумуляторы соединяют электрическими контактами в батареи. Различают аккумуляторные батареи и батареи элементов.
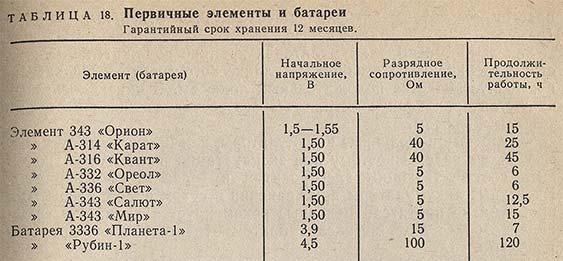
Сухие элементы и батареи. Они предназначены для питания различных устройств в тех случаях, когда необходим автономный и портативный источник постоянного тока небольшой мощности.
Выпускают элементы и батареи, готовые к действию (заряженные), содержащие электролит, и резервные (наливные), которые приводятся в действие путем контакта электродов с электролитом или перевода электролита в рабочее состояние.
По конструктивной форме элементы подразделяются на прямоугольные, цилиндрические и галетные (плоские).
На каждом элементе (батарее) заводского изготовления указаны номер ГОСТ или ТУ, условный номер или наименование, номинальное напряжение, гарантийный срок хранения, дата изготовления и полярность выводов («+» и «-»).
Цилиндрические элементы сухие и прямоугольные батареи марганцево-цинковой системы с солевым или щелочным электролитом часто используются в лабораторной практике (табл. 18).
Аккумуляторы. По типу электролита аккумуляторы подразделяются на кислотные (свинцовые) и щелочные - никель-кадмиевые (НК) и никель-железные (НЖ).
Кислотный аккумулятор состоит из сосуда (стеклянного, эбонитового, пластмассового или деревянного, выложенного листовым свинцом), пластин-электродов, сепараторов и электролита. Решетка пластин отлита из свинца с добавкой веществ, повышающих твердость свинца (Sb, Sn, Sr).
Сепараторы - тонкие прокладки из пористого материала (типа мипоры) служат для предупреждения замыкания между положительными и отрицательными пластинами. Ячейки решетки заполнены пастообразной активной массой. Сосуд закрывается крышкой с тремя отверстиями: по краям для вывода полюсных штырей, а среднее - для заливки электролита; оно плотно закрывается металлической пробкой на резьбе.
Щелочные аккумуляторы состоят из электродов, собранных в комплекте положительных и отрицательных пластин, стального сосуда и ряда деталей (выводы, пробка и др.). Внутри пластин заключена активная масса в виде отдельных пакетов (ламелей); между пластинами проложены эбонитовые палочки. В никель-кадмиевых аккумуляторах крайние положительные пластины соединены со стенкой металлического сосуда, следовательно, корпус является положительным полюсом. В никель-железных аккумуляторах корпус металлического сосуда соединен с отрицательным полюсом.
Кислотные и щелочные аккумуляторы, как правило, выпускаются в сухом виде, и поэтому для эксплуатации их требуется заполнить соответствующим электролитом и вслед за этим зарядить. Кислотные аккумуляторы при хранении в сухом виде с закрытыми пробками не портятся; щелочные рекомендуется хранить в сухом виде не более двух месяцев и притом обязательно с закрытыми пробками.
Электролиты для аккумуляторов. Электролитом для кислотных аккумуляторов служит 35-40% раствор химически чистой H2S04 в дистиллированной воде (р = 1260-1300 кг/м3). При правильном уходе за аккумулятором электролит не требует замены на протяжении 12-16 месяцев. Гарантированная емкость щелочных аккумуляторов обеспечивается при применении составного электролита из раствора КОН (р = 1190-1210 кг/м3) с добавкой 20+1 г/л LiOH-H2O. В качестве составного электролита можно также применить раствор NaOH (р = 1170-1190 кг/м3) с добавкой 10 г/л LiOН-Н2O. В щелочных аккумуляторах электролит подлежит периодической замене через 8-10 месяцев.
При приготовлении электролита, как кислотного, так и щелочного, имеет место разогревание. Наливать в аккумуляторы горячий электролит нельзя, надо дать ему остыть до комнатной температуры. В аккумулятор наливают электролит через воронку в таком количестве, чтобы уровень раствора был по крайней мере на 10-12 мм выше пластин. О высоте этого уровня можно судить, опуская в отверстие для пробки узкую стеклянную трубку. Закрыв верхний конец трубки пальцем, трубку осторожно вынимают и отмечают высоту уровня жидкости в ней. Затем отверстие в крышке аккумулятора плотно закрывают.
Ввиду того что электролит частично впитывается в пластины, через некоторое время нужно долить электролит и измерить его плотность. Для замера плотности при температуре близкой к 20 °С кроме обычного ареометра часто используют сифонный ареометр.
Электролит сменяют через каждые 100-150 зарядно-разрядных циклов, руководствуясь заводской инструкцией. Перед сменой электролита аккумуляторы разряжают. Старый электролит выливают, энергично встряхивая аккумулятор (батарею) для удаления грязи из сосуда и промывают дистиллированной водой.
Промытые аккумуляторы следует немедленно залить свежеприготовленным, электролитом, дать постоять 2 ч, затем замерить плотность раствора в аккумуляторе, довести ее до требуемой величины и закрыть аккумуляторы пробками.
Приведение аккумуляторов в рабочее состояние. Для приведения аккумуляторов в рабочее состояние масса электродов должна быть отформована. Процесс электрохимического формования осуществляется путем заряда и разряда аккумулятора. Формование никель-железных аккумуляторов заканчивается после двух зарядно-разрядных циклов, для никель-кадмиевых - через 3-4, для кислотных - через 6-8 циклов.
В заводских инструкциях по эксплуатации аккумуляторов предусматриваются нормальные зарядные и разрядные режимы, при которых гарантируется надежная работа аккумуляторов. Для заряда аккумулятор подключают к внешнему источнику постоянного тока плюсом к плюсу и минусом к минусу. Конечные напряжения заряда и разряда являются нормированными величинами (ГОСТ 9241-71).
Конечное напряжение разряда для кислотных аккумуляторов при нормируемых режимах разряда составляет 1,7-1,8 В, а для щелочных 1 В. Конечное напряжение заряда составляет для кислотных аккумуляторов 2,6-2,7 В, а для щелочных 1,56-2,05 В.
Критерием окончания заряда является совокупность признаков: напряжение остается постоянным в течение часа; плотность электролита в течение этого времени не изменяется; происходит сильное газообразование.
При заряде аккумулятора нельзя допускать повышения температуры электролита выше 40-45 °С, так как емкость аккумулятора при этом резко уменьшается.
Причины порчи аккумуляторов. Основными причинами порчи кислотных аккумуляторов являются саморазряд, достигающий около 1% его емкости в сутки, и сульфатация - отложение на поверхности пластин Na2SO4, плохо проводящего ток. Быстрый саморазряд может возникнуть из-за коротких замыканий между пластинками вследствие выпадения активной массы из пластин, а также из-за чрезмерных токов при заряде и разряде. Сульфатация является результатом несвоевременного заряда разряженных аккумуляторов. Особенно бурно происходит сульфатация пластин при переплюсовке аккумулятора, т.е. вследствие неправильного подключения аккумулятора к источнику постоянного тока при заряде. Об определении полярности электродов см. приложение 3.
Порча щелочных аккумуляторов вызывается в основном перегреванием электролита, зарядом током больше нормированного, переплюсовкой, образованием карбонатов и закупоркой клапанов пробок.
Правила ухода за аккумуляторами.
1. Не допускать при разряде уменьшения напряжения аккумуляторов ниже нормируемых величин. Замерять напряжение можно аккумуляторным пробником типа М209 или надежным вольтметром.
2. Не допускать коротких замыканий, в особенности у кислотных аккумуляторов.
3. Не превышать нормированных значений тока как при заряде аккумуляторов, так и при их разряде, т.е. при питании электрической цепи.
4. Следить за емкостью аккумуляторов. Уменьшение емкости у свинцовых аккумуляторов - первый признак сульфатации пластин, у щелочных - необходимости замены раствора электролита.
5. При длительном перерыве в эксплуатации аккумуляторов необходимо: щелочные аккумуляторы зарядить и хранить заполненными (2-2,5 месяцев), а кислотные, после полного разряда, слив электролит, промыть дистиллированной водой и хранить с закрытыми пробками в сухом виде.
6. Внимательно следить за исправностью клапанов в пробках щелочных аккумуляторов, а у свинцовых - чтобы не засорилось отверстие в пробке, служащей для выхода газа.
7. Следить за чистотой крышек и клемм аккумуляторов. Для удаления налетов и кристаллических осадков следует пользоваться деревянной палочкой и куском ткани. Полезно крышки смазать вазелином.
8. При заряде аккумуляторов надо вывертывать пробки. Через 10-15 мин после окончания заряда пробки завертывают и тряпкой удаляют с крышек раствор, выплескивающийся обычно в конце заряда вследствие сильного газообразования. Нельзя к пробкам аккумуляторов подносить огонь, так как под их крышками находится гремучий газ.
Измерение электрических величин
Методы и средства измерения электрических величин весьма разнообразны. Менее точные измерения (с погрешностью около 0,1%) осуществляются приборами непосредственной оценки. Более точные измерения выполняют с помощью приборов сравнения определяемой величины с образцовой мерой.
Приборы непосредственной оценки электрических величин - показывающие приборы - используются также и для косвенного определения некоторых неэлектрических величин, как например, определения температуры термометром сопротивления, освещенности при помощи люксметра и т.д.
Приборы непосредственной оценки
Эти приборы дают значение измеряемой величины, определяемое по предварительно проградуированным счетным приспособлениям (шкалы, диаграммы). Их назначение определяется измеряемой величиной (ток, напряжение и др.). Они характеризуются классом точности, системой (определяемой принципом действия прибора), диапазоном измерений и условиями эксплуатации.
Показывающие измерительные приборы (стрелочные, со световым указателем и цифровые) выпускаются для измерений в цепях переменного тока, постоянного тока или в цепях переменного и постоянного тока.
Выбор соответствующего измерительного прибора должен быть сделан на основе справочных данных.
Лабораторные и переносные показывающие электроизмерительные приборы обычно имеют несколько пределов измерений, что достигается с помощью встроенных в прибор переключателей. На лицевой панели размещаются зажимы для включения прибора в схему, переключатели и букса корректора для установки указателя на отметку механического нуля.
Шкалы многих приборов класса точности 0,1; 0,2; 0,5 и 1,0 со стрелочным указателем снабжены зеркальными антипараллаксными устройствами. Приборы со световым указателем погрешности от параллакса не имеют.
Гальванометры - электроизмерительные приборы высокой чувствительности для измерения малых значений тока, напряжения или количества электричества. Гальванометры также служат нулевыми приборами для определения с большой точностью отсутствия тока в замкнутой электрической цепи или нулевой разности потенциалов между двумя точками в ее параллельных ветвях.
В лабораторной практике применяются гальванометры постоянного и переменного тока. Наиболее распространены гальванометры постоянного тока магнитоэлектрической измерительной системы - стрелочные для нулевых измерений в мостовых и компенсационных системах и зеркальные для индикации и измерения тока, напряжения, заряда магнитного потока, сравнения токов в двух независимых цепях.
Амперметры - приборы для измерения электрического тока, включаемые последовательно в цепь этого тока. В зависимости от значений номинальных токов различают амперметры, миллиамперметры и микроамперметры.
Значение электрического тока, измеряемого амперметром, определяется по отклонению подвижной системы амперметра. Для измерения постоянного тока применяют главным образом амперметры магнитоэлектрической системы - одно- и многопредельные. Благодаря конструкции переключателя можно переключать пределы измерения без разрыва электрической цепи.
Для измерения переменного тока также применяют многопредельные амперметры.
Вольтметры - приборы для измерения напряжения между двумя точками электрической цепи, подключаемые параллельно приемнику энергии.
Для уменьшения ошибки измерения вольтметр должен потреблять возможно меньший ток, т.е. вольтметр тем лучше, чем больше его собственное внутреннее сопротивление.
Для выполнения различных измерений служат переносные вольтметры разных систем и классов точности, с различным внутренним сопротивлением, одно- и многопредельные, различные по чувствительности и роду тока и разнообразные по конструкции.
Электрические измерения методом сравнения
В практике химических лабораторий часто пользуются нулевым методом измерения, основанным на приведении к нулю разности измеряемой и известной величины, так что их совокупное действие на нулевой прибор (гальванометр) полностью уравновешивается.
Примерами нулевого метода измерения являются компенсационный метод определения напряжения малых постоянных токов и мостовой метод измерения сопротивлений.
Точность нулевого метода определяется классом точности образцовых мер и чувствительностью нулевого прибора (гальванометра).
Компенсационный метод измерения напряжений. Сущность метода заключается в том, что к измеряемому напряжению подключают в противоположном направлении точно известное напряжение (образцовая мера). Компенсирующее напряжение снимают с образцового потенциометра.
Потенциометры (компенсаторы) - приборы сравнения, служащие для измерения компенсационным методом э.д.с., напряжений (реже токов) или величин, функционально с ними связанных. В этих приборах в процессе измерения производится сравнение измеряемой величины или ее части с электрической мерой, например с э.д.с. нормального элемента.
Различают потенциометры постоянного и переменного тока, одно- и многопредельные.
В практике химических лабораторий используются большей частью потенциометры постоянного тока с двумя рядами измерительных декадных переключателей, с диапазонами измерения 0,01 мкВ - 2,121111 В и универсальный потенциометр постоянного тока УПЛ-80-2 с тремя верхними пределами измерения: 2,511110; 0,11110 и 0,011111 В.
В качестве меры э.д.с. для проверки и градуировки электро-измерительных приборов в лабораторных и цеховых условиях служат нормальные элементы.
Нормальные элементы - обратимые гальванические элементы, дающие при постоянных температурах и давлении устойчивые э.д.с., значения которых могут быть точно воспроизведены.
В зависимости от концентрации электролита различают насыщенные и ненасыщенные нормальные элементы.
В насыщенных нормальных элементах (НЭ-65 и Х-482) положительным электродом служит ртуть, покрытая пастой из Hg2SO4 (деполяризатор), растертого со ртутью и кристаллами CdSO4-8H2O, а отрицательным - амальгама кадмия (10% Cd и 90% Hg). Электролитом служит насыщенный раствор CdSO4, подкисленный 0,03 н. H2SO4 и содержащий избыток кристаллов CdSO4-8H2O.
В насыщенных элементах (Х-485 и Х-487) электролитом служит насыщенный при 4 °С водный раствор CdSO4 (т.е. при комнатной температуре ненасыщенный).
Э.д.с. нормальных элементов зависит от температуры; нормальной температурой для этих стандартных мер считается 20 °С.
Нормальный элемент Х-485 класса точности 0,005; э.д.с. при 20 °С равна 1,01880-1,01960 В. Рабочий диапазон температур 17-23 °С.
Нормальный элемент Х-487 класса точности 0,001; термостатирован; его э.д.с. при 20 °С равна 1,01854-1,01873 В.
Мостовой метод измерения сопротивления. Метод измерения электрических сопротивлений постоянному или переменному току при помощи измерительных мостов находит широкое применение в измерениях физических величин, функционально связанных с электрическим сопротивлением (удельная проводимость и температурный коэффициент сопротивления - при постоянном токе, емкость, частота и др. - при переменном).
Измерительные мосты - приборы для измерения электрического сопротивления постоянному или переменному току методом сравнения с образцовым сопротивлением.
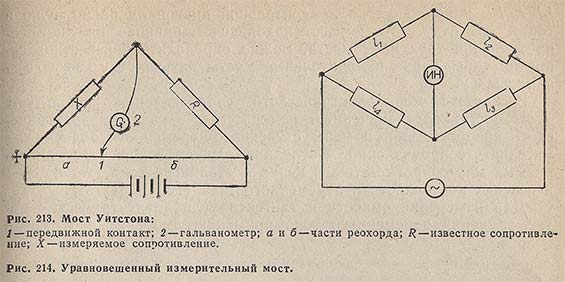
В простейшем случае измерение сопротивлений осуществляется при помощи мостика сопротивления, построенного по принципу моста Уитстона (рис. 213). При измерении скользящий контакт 1 потенциометра перемещают до тех пор, пока стрелка гальванометра 2 не станет на нуль. В этом положении неизвестное сопротивление относится к известному сопротивлению, как длина участка реохорда а к длине участка b:
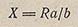
Большинство измерительных мостов построено по принципу сравнения с образцовым сопротивлением в схеме замкнутого четырехугольника (рис. 214). Сопротивления l1-l4, образующие замкнутый четырехугольник, называются плечами моста. В одну из диагоналей моста включается источник питания, в другую (измерительную) индикатор нуля (ИН). При соотношении плеч l1l3 = l2l4 напряжение на измерительной диагонали равно нулю и ток в ИН отсутствует - мост находится в равновесии. Зная сопротивления трех плеч моста, можно определить неизвестное сопротивление. Такие измерительные мосты называют уравновешенными.
В качестве мер электрического сопротивления используют меры постоянного значения - измерительные катушки электрического сопротивления и меры ступенчато-переменного значения - магазины сопротивлений. Последние служат в качестве регулируемых мер сопротивления в цепях постоянного тока (тип Р 362) и в цепях постоянного и переменного тока (тип Р 517 М).
Для измерения емкости и тангенса угла диэлектрических потерь в цепях переменного тока применяют мост измерительный Р 5026.
