Химические реактивы
Результативность работы химика в значительной мере зависит от степени чистоты применяемых веществ. Согласно ГОСТ 13867-68 «Продукты химические. Обозначения чистоты», все химические продукты подразделяются на четыре группы:
1) сырые продукты - природного происхождения и полуфабрикаты с большим содержанием примесей;
2) технические продукты, вырабатываемые химическими предприятиями, с относительно небольшим содержанием примесей;
3) реактивы, предназначаемые для аналитических, препаративных и иных работ в лабораториях;
4) продукты особой чистоты, качество которых значительно выше химических реактивов.
В лабораторной практике используются реактивы и особо чистые вещества, качество которых регламентируется государственными стандартами и техническими условиями.
Качество химических веществ, используемых в фармацевтической практике, регламентируется Государственной фармакопеей (ныне действует десятое издание - ГФ-Х).
Квалификация реактивов и высокочистых веществ
В зависимости от содержания основного вещества и допустимых примесей для химических реактивов установлены следующие квалификации.
Чистый (ч.) - низшая квалификация реактива. Содержание основного вещества не менее 98%; содержание примесей или нелетучего остатка 0,01-0,5%; остаток после прокаливания - до 0,5%.
Чистый для анализа (ч. д. а.). Эта квалификация характеризует аналитическое применение препарата. Содержание основного вещества не менее 99%.
Химически чистый (х. ч.). Высшая степень чистоты препарата. Содержание отдельных примесей в пределах 0,001-0,00001% и нелетучего остатка не более 0,1%; остаток после прокаливания не более 0,1%.
Высокочистые вещества, подразделяемые на спектрально-чистые (сп. ч.), эталонной чистоты (в. э. ч.) и особо чистые (ос. ч.).
Содержание основного вещества и предельное содержание нежелательных примесей в эталонно-чистых веществах должно соответствовать марке эталона (в зависимости от его назначения).
Перед символом в. э. ч. стоит цифра, обозначающая общее процентное содержание лимитируемых примесей, а после символа - две цифры, разделенные тире; первая означает число лимитируемых примесей, а вторая - максимальное содержание этих примесей (в процентах), выраженное как абсолютное значение показателя степени порядкового множителя. Например, марка вещества эталонной чистоты, содержащего 99,998% основного вещества, в котором лимитируется три примеси, причем их общее содержание не должно превышать 0,00001%, обозначается «002 в. э. ч. 3-5».
Содержание примесей в особо чистых веществах лимитируется в пределах 10 в минус 5 – 10 в минус 10%.
Если в веществе особой чистоты лимитируются лишь неорганические примеси, то за символом ос. ч. следуют две цифры, из которых первая указывает число лимитируемых примесей, а вторая - их суммарное содержание (в процентах), выраженное как абсолютное значение показателя степени порядкового множителя. Например, марка «кремний ос. ч. 21-5» означает, что в кремнии лимитировано содержание 21 неорганической примеси, суммарное содержание которых не превышает 0,00001%.
Если для особо чистых веществ лимитируются только органические примеси, перед символом ос. ч. ставятся буквы «оп» с цифрой, обозначающей их предельное содержание. Например, марка особо чистого вещества с суммарным содержанием органических примесей 0,001% обозначается «оп-3 ос. ч.».
Марка особо чистых веществ, для которых лимитируются как неорганические, так и органические примеси, обозначается с учетом содержания этих примесей. Например, марка вещества, для которого сумма органических примесей лимитируется величиной 0,0001%, а сумма восьми неорганических примесей составляет 0,00001%, обозначается «оп-4 ос. ч. 8-5».
Высокочистые вещества используются в новых отраслях техники, и в зависимости от области применения к ним предъявляются особые технические требования.
Химические реактивы классифицируют часто по областям их преимущественного применения: индикаторы, красители для микроскопии, для хроматографии (сорбенты, носители, неподвижные фазы н др.), для люминофоров, для фотографии, для криоскопии, для спектрального анализа и т. д.
Во многих случаях после названия реактива указывается область применения реактива, а затем степень его чистоты. Например: бензол для криоскопии х. ч., судан Ж краситель для микроскопии ч. д. а., кальция окись для хроматографии ч. д. а. и т. д.
Единой международной квалификации химических реактивов и высокочистых веществ не существует. Реактивы, поставляемые странами-членами СЭВ, квалифицируются так, как принято в СССР.
Согласно ГОСТ 3885-73, реактивы (препараты) должны быть упакованы в соответствующую потребительскую тару, герметически упакованы и снабжены стандартной этикеткой.
Для реактива каждой квалификации этикетка на таре должна быть определенного цвета или на этикетке должна быть цветная полоса:

При наличии у реактивов ядовитых, огнеопасных и взрывоопасных свойств наклеивается отдельная этикетка с надписями «Огнеопасно» - красная; «Яд» - желтая; «Взрывоопасно» - голубая; «Беречь от воды» - зеленая.
Опасные свойства реактивов
Многие химические вещества обладают опасными свойствами, существенно влияющими на стабильность качественных показателей препарата, а также способными послужить причиной пожара, взрыва, отравления или заболевания персонала.
Влагочувствительность. В зависимости от способности поглощать влагу из воздуха различают малогигроскопические (нитрат бария), сильногигроскопические (гидроксиды натрия и калия, ортофосфорная кислота, ацетат натрия, хлорид алюминия) и расплавляющиеся на воздухе вещества (диметиламин сульфат, ацетамидин гидрохлорид).
Поглощение влаги из воздуха может происходить при негерметичной упаковке реактива.
Взаимодействие с влагой воздуха может носить чисто физический характер (увлажнение, растворение), но поглощаемая влага может привести и к необратимой химической реакции. Так, сульфиды, нитриды, фосфиды щелочных и щелочноземельных металлов разлагаются водой с образованием токсичных гидридов; галогениды неметаллов (РСl3, PCl5, S2Cl2 и др.) и галогенангидриды кислот гидролизуются с образованием соответствующих кислот; щелочные, щелочноземельные и пирофорные металлы взаимодействуют с водой с выделением водорода (что грозит взрывом).
Светочувствительность. Под действием света некоторые вещества подвергаются фотохимическим реакциям.
Одни вещества при этом изменяют цвет (аллилбромид, анилин, соли бромисто- и йодистоводородных кислот, препараты ртути, салициловой кислоты, фенолы и др.), другие подвергаются окислению (фурфурол, ксантогидрол) или восстановлению (соединения серебра).
Действие света может сопровождаться также процессами изомеризации и фотолиза. Например, малеиновая кислота под действием света частично превращается в транс-изомер - фумаровую кислоту, а фотолитический распад трихлорэтилена сопровождается образованием дихлорацетилена, оксида углерода, фосгена и хлористого водорода:

Теплочувствительность. Значительное изменение температурных условий при хранении реактива может повлечь за собой как обратимые (переход в другое агрегатное состояние), так и необратимые изменения его свойств. Вещества, подвергающиеся необратимым изменениям при воздействии тепла или холода, называют термолабильными.
Например, формалин (водный раствор формальдегида) при температуре ниже 9 °С образует белый осадок параформа, который при последующем нагревании не переходит в раствор.
Металлическое олово («белое» олово) при -30 °С переходит в a-модификацию («серое» олово) в виде серого мелкого порошка.
При повышенной температуре многие кристаллогидраты теряют воду (при 30 °С СаСl2-6Н2O переходит в СаСl2-4Н2O), а некоторые вещества разлагаются, например карбонат аммония разлагается при 58°С по уравнению
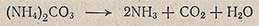
или полимеризуются (непредельные углеводороды, B-аминопропионитрил, олеиновая кислота и др.).
Пожароопасность. Многие химические вещества самопроизвольно или при действии внешнего источника зажигания способны к загоранию, а некоторые - к взрыву.
Пожароопасные вещества условно разделяют на группы.
1. Реактивы, способные к разложению со взрывом и в отсутствие кислорода воздуха. Они способны взрываться не только от внешнего теплового или электрического источника, но также от удара, трения, детонации (перхлорат аммония, дипикриламин и его аммонийная соль, пикриновая кислота, 2,4,6-тринитротолуол, азиды, многие перекиси и др.).
Для уменьшения взрывоопасности некоторые реактивы рекомендуется сохранять увлажненными. Так, пикриновая кислота с влажностью более 40% не является взрывоопасным веществом.
2. Сжатые, сжиженные и растворенные под давлением газы, например легковоспламеняющиеся водород, метан, ацетилен, оксид углерода (II), аммиак, метиламин, диметиламин, диборан, сероводород, циановодород, этиламин, хлористый метил, триметиламин, трифторэтилен; поддерживающие горение сжатый и жидкий воздух, сжатый и жидкий кислород, оксид азота (I).
3. Реактивы, выделяющие при взаимодействии с водой легковоспламеняющиеся газы (Na, К, Са, СаН2, СаС2 и др.). Так, щелочные металлы при контакте с водой выделяют водород, самовоспламеняются со взрывом и разбрызгиванием металла. Карбиды, взаимодействуя с водой, выделяют ацетилен, метан и другие углеводороды. Карбиды щелочных металлов реагируют с водой со взрывом. Карбиды меди, серебра, ртути способны взрываться от удара и нагревания.
Гидриды металлов при увлажнении выделяют водород, а некоторые, например гидрид метилалюминия, воспламеняются.
В присутствии воды способны разлагаться со взрывом амид натрия, хлорсульфоновая кислота, бромид алюминия.
4. Легковоспламеняющиеся жидкости (ЛВЖ), способные без предварительного подогревания возгораться от кратковременного контакта с источником зажигания (спичка, искра и т. п.).
Об огнеопасности органических растворителей принято судить по температуре вспышки tвсп, т. е. по наименьшей температуре, при которой пары данного вещества образуют над поверхностью его смесь с воздухом, вспыхивающую при приближении пламени. Вещества, температура вспышки которых в закрытом сосуде ниже 61 °С или 65 °С и ниже в открытом, принято относить к легковоспламеняющимся.
Критерием пожароопасности является также температура самовоспламенения, т. е. температура, при которой вещество загорается без постороннего открытого источника огня или электрической искры.
ЛВЖ по степени пожароопасности подразделяются на три категории: особоопасные - с tвсп < 18°С (диэтиловый эфир, сероуглерод, тетралин); опасные - с tвсп 18-23°С в закрытом сосуде (ацетон, бензол, диоксан, метилацетат, этилацетат, метиловый и этиловый спирты и др.); опасные при повышенной температуре - с tвсп = 23-61 °С в закрытом сосуде (многие спирты, изопропилбензол, уксусная кислота, метилцеллозольв и др.).
5. Легковоспламеняющиеся твердые реактивы, способные возгораться от источника огня и распространять горение по поверхности (красный фосфор, сера, селен, кремний, нитроцеллюлоза, целлулоид и другие нитросоединения, гексаметилентетрамин, диметилглиоксим, пирокатехин, нафталин и др.).
6. Самовозгорающиеся реактивы, способные при контакте с воздухом или другими веществами самонагреваться и самовоспламеняться при нагревании до сравнительно невысоких температур (пирофорные металлы, многие металлорганические вещества, белый фосфор, сульфоуголь, катализатор Ренея и др.).
7. Воспламеняющие (окисляющие) реактивы, способствующие развитию горения. Эти вещества сами по себе не горючи, но, выделяя кислород, увеличивают интенсивность огня и в смеси с другими веществами могут вызвать взрыв. К ним относятся перекиси щелочных и щелочноземельных металлов, азотная кислота и некоторые ее соли, безводная хлорная кислота, хлораты, броматы, йодаты, перманганаты, соли надсерной кислоты и др.
Ядовитость. Большинство применяемых в химических лабораториях веществ в той или иной степени ядовиты. Они могут воздействовать на организм человека в виде газов, паров, жидкостей, твердых веществ, а также в аэрозольном (пыль, дым, туман) состоянии.
Важным фактором безопасности является надежно работающая вентиляция, способная снижать в рабочей зоне концентрацию вредных веществ ниже ПДК. По величине ПДК судят о классе опасности вещества.
Хранение реактивов
В лабораторном помещении должны храниться лишь небольшие запасы химических веществ. Их держат в банках, склянках с пришлифованными стеклянными пробками или пластмассовыми крышками с герметизирующими прокладками из полиэтилена.
На каждом сосуде должна быть этикетка с обозначением, что в нем находится. Для лучшей сохранности бумажные этикетки рекомендуется заклеивать прозрачной полиэтиленовой клейкой лентой. Временные надписи могут быть сделаны карандашом для стекла: место, на которое намечается надпись, следует слегка нагреть.
Строго запрещается хранить вещества в сосудах без этикеток или надписей! Если этикетки нет, применять реактив нельзя. Если не удается установить состав реактива, его следует уничтожить.
Небольшие количества веществ, выделяющих ядовитые или раздражающие дыхательные пути пары (бром, олеум, фтористоводородная и концентрированная соляная кислоты, аммиак, тионилхлорид, сульфурилхлорид и др.), равно как и концентрированных серной, азотной, уксусной кислот допустимо хранить в вытяжном шкафу на специально отведенных для них полках.
Запасы подобных веществ следует хранить в вытяжных шкафах вентилируемых хранилищ, доступ в которые должен быть ограничен.
Общий запас одновременно хранящихся в каждом рабочем помещении лаборатории огнеопасных и легковоспламеняющихся жидкостей не должен превышать суточной потребности, но не более 2-3 л на одного сотрудника. Склянки, в которых содержится более 50 мл ЛВЖ, должны храниться в железных ящиках для горючего с плотно закрывающейся крышкой, со стенками и дном, выложенными асбестом. Ящик устанавливают на полу вдали от нагревательных приборов; к нему должен быть удобный подход. Запрещается хранить горючие жидкости в полиэтиленовой и в тонкостенной посуде вместимостью более 200 мл. Недопустимо хранить горючие жидкости в вытяжном шкафу, где производят работы с нагревательными приборами или рядом с окислителями (Сl2, Н2O2, Br2, KMnO4 и др.).
Щелочные металлы следует хранить под слоем обезвоженного трансформаторного масла или керосина в стеклянной банке, плотно закрытой корковой пробкой. Слой масла (керосина) над металлом должен быть не менее 15-20 мм.
Количество металлического натрия или калия, хранящихся в лабораторном помещении, не должно превышать однодневной потребности. При длительном хранении на поверхности металлического калия образуются перекиси, которые при непосредственном контакте с металлическим калием (например, при разрезании ножом на воздухе) дают сильные взрывы.
Перекисные соединения следует хранить, как огне- и взрывоопасные вещества. Температура их хранения должна быть значительно ниже температуры их разложения. Нестабильные перекиси хранят при пониженной температуре. Органические перекиси и гидроперекиси хранят только в емкостях из стекла или полиэтилена высокого давления.
Реактивы, изменяющиеся под действием света, хранят в желтых или темных склянках и банках.
Ядовитые вещества (соли ртути (II), алкалоиды, некоторые эфиры фосфорной кислоты, цианиды) следует хранить в вентилируемых закрытых и опечатанных шкафах и сейфах.
Металлическую ртуть в относительно малых количествах хранят в толстостенной герметически закрытой стеклянной посуде в вытяжном шкафу. Надежно и удобно хранение ртути в запаянных стеклянных толстостенных ампулах по 30-40 мл. Ампулы рекомендуется укладывать в тонкостенные стальные коробки. В таком виде ртуть можно держать в лабораторных шкафах вместе с другими реактивами.
При хранении запасов реактивов в первую очередь следует организовать раздельное хранение веществ, несовместимых по свойствам. Например, хлорат калия, перманганат калия, перекись водорода и другие окислители нельзя хранить рядом с восстановителями - серой, крахмалом, углем и др.
Обращение с реактивами
По назначению реактивы могут быть условно разделены на общеупотребительные и специальные.
Общеупотребительные реактивы, расход которых может быть значительным (кислоты, основания, некоторые соли, спирты и полупродукты для синтетических работ), часто поступают в лабораторию в крупной расфасовке. Поэтому часто возникает необходимость отвешивать и отмеривать небольшие массы и объемы реагентов.
Твердый реактив при хранении может слежаться. Иногда достаточно потрясти банку, чтобы он рассыпался. В других случаях приходится разрыхлять верхний слой тщательно очищенным, сухим фарфоровым или роговым (но не металлическим) шпателем или стеклянной палочкой.
При вскрытии банки с реактивом следует сначала очистить пробку снаружи, затем обтереть ее и горло банки чистым полотенцем.
При взвешивании необходимо позаботиться о сохранении чистоты реактива. Нельзя насыпать его прямо на чашку весов или на бумагу. При взвешивании небольших количеств следует пользоваться стаканчиками для взвешивания (бюксами). Нельзя брать реактив руками и возвращать излишки обратно в банку! Рассыпанный реактив надо немедленно убрать.
Жидкие реагенты взвешивают в склянках, снабженных притертыми пробками.
Относительно большие количества реактивов следует взвешивать в чистых, сухих банках со стеклянными и пластмассовыми пробками. Пересыпать твердые реактивы и препараты из большой емкости в малую удобно с помощью воронок для порошков; при этом большую банку медленно вращают и слегка наклоняют, чтобы вещество высыпалось тонкой струйкой.
Едкие вещества - дымящие концентрированные кислоты (HNO3, H2SO4, НСl), хлорангидриды кислот (SOCl2, РСl3 и др.), 25% раствор аммиака и другие сильнодействующие вещества (метиловый спирт, дихлорэтан, эфир и др.) - часто поступают в лаборатории в больших бутылях. Перевозить, переносить и хранить подобные бутыли без обрешетки или корзины запрещается.
При переливании жидких реактивов из больших бутылей целесообразно пользоваться металлическими стояками для бутылей (рис. 54) и приспособлениями, которые дают возможность легко наклонять бутыли (рис. 55).
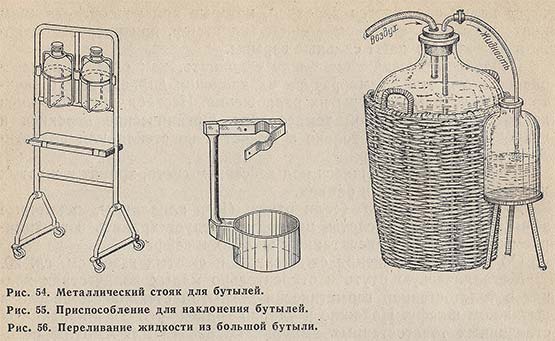
Кислоты, щелочи и другие едкие жидкости из больших бутылей следует разливать при помощи стеклянных сифонов с грушей (рис. 56) или других нагнетательных средств, желательно в вытяжном шкафу при включенной тяге.
Случайно разлитый жидкий едкий реагент сразу же засыпают сухим песком, чтобы он впитал жидкость. Намокший песок убирают, и это место засыпают известью или карбонатом натрия, если разлиты кислоты или галогенангидриды, либо заливают 2% раствором уксусной кислоты, если разлиты щелочи или водный аммиак. После такой обработки замывают водой и вытирают насухо. На рабочем месте необходимо иметь достаточное количество нейтрализующих средств.
При переливании едких жидкостей обязательно пользоваться защитными перчатками и очками, а также прорезиненным фартуком.
Расходные количества концентрированных кислот (HNO3, H2SO4, НСl) должны храниться в толстостенной стеклянной посуде вместимостью не более 2 л в вытяжном шкафу на стеклянных или фарфоровых поддонах. Хранить кислоты можно также в нижней части вытяжного шкафа, если только туда не вмонтированы сантехпроводы, которые в присутствии кислот могут корродировать. Склянки с дымящей HNO3 следует хранить в специальных ящиках из нержавеющей стали, выложенных асбестом.
Концентрированные растворы щелочей не поставляются промышленностью, и их приходится приготовлять в лабораторных условиях. Для приготовления раствора NaOH, не содержащего Na2CO3, пользуются тем, что Na2CO3 нерастворим в концентрированном растворе NaOH. Для этого 200 г NaOH (ч. д. а.) помещают в колбу из стекла «пирекс» и растворяют в 200 мл воды, добавляемой постепенно небольшими порциями. Когда вся щелочь растворится, останется Na2CO3 в виде суспензии, очень медленно оседающей на дно. Полученный раствор фильтруют через асбестовый фильтр в фарфоровом тигле с пористым дном в условиях, не допускающих загрязнения раствора СO2 воздуха. Отделить Na2CO3 можно также декантацией или центрифугированием. Концентрированный раствор NaOH хранят в полиэтиленовых бутылях и склянках.
При работе с жидкими органическими реагентами, растворами кислот и оснований запрещается засасывание их в пипетки ртом.
Щелочные металлы
При работе с металлическими калием и натрием необходимо соблюдать особую осторожность, не допуская соприкосновения их с водой, галогенсодержащими органическими соединениями и твердым CO2 (сухим льдом).
Работу со щелочными металлами выполняют в вытяжном шкафу, пользуясь защитными очками и резиновыми перчатками.
Запаянные металлические банки с блоком металлического натрия или калия в парафине (сухая упаковка) надо вскрывать осторожно, избегая ударов молотком или другими металлическими предметами. Блок металлического натрия можно разрезать ножом и большие куски быстро поместить в заранее подготовленные толстостенные стеклянные банки с обезвоженным керосином или трансформаторным маслом. Блок металлического калия можно разрезать только под слоем обезвоженного трансформаторного масла. Банки со щелочными металлами хранят в металлическом ящике с песком на дне (на случай аварии).
Из банки натрий вынимают лабораторными щипцами, кладут на лист фильтровальной бумаги, ножом отрезают нужное количество, срезают пленку оксида и сейчас же используют в работе. Обрезки собирают в отдельную банку из толстого стекла, заполненную на 1/3 объема обезвоженным керосином.
Разрезание металлического калия и срезание оксидной пленки следует производить под слоем обезвоженного трансформаторного масла, после чего кусочки металла осторожно переносят в сосуд с безводным диэтиловым эфиром (для освобождения от масла).
Обрезки металлического калия собирают отдельно от обрезков металлического натрия. Категорически запрещается накапливать более 2 г обрезков натрия или калия.
Обрезки щелочных металлов, которые нельзя использовать в работе, уничтожают либо превращением их в алкоголяты, либо сжиганием. Чаще всего используют первый способ. Для этого отходы щелочных металлов небольшими порциями вносят в 80-85% этиловый спирт. По растворении металла и охлаждении жидкости вносят новую порцию отходов. Полученный раствор разбавляют большим объемом воды и сливают в канализацию.
При работе со щелочными металлами нельзя пользоваться водяными или паровыми банями, а только масляными, песчаными или воздушными.
В лабораториях органического синтеза часто нужен порошкообразный натрий. Чтобы получить порошок, натрий, предварительно очищенный от оксида, помещают в колбу с обратным холодильником и заливают десятикратным (по массе) количеством толуола или ксилола, высушенного над натрием. Смесь нагревают на силиконовой бане, пока весь натрий не расплавится. Тогда нагревание прекращают, колбу закрывают пробкой (желательно пришлифованной стеклянной) и, завернув ее в полотенце, энергично встряхивают, чтобы образовались мелкие капельки натрия, быстро затвердевающие по мере остывания колбы. После полного охлаждения ксилола его декантируют, а натрий заливают сухим диэтиловым эфиром или же непосредственно вводят в реакцию.
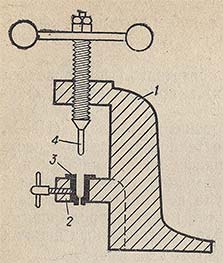
Для приготовления натриевой проволоки пользуются специальным прессом (рис. 57). В гнездо пресса 2 вставляют чистый сухой патрон 3 и помещают в него кусочки натрия, с поверхности которых предварительно .удалена корка. Наполнив больше половины патрона, вводят в него поршень и плотно придавливают кусочки натрия. Затем поднимают поршень, добавляют еще немного натрия, медленно опускают поршень и с перерывами вращают винт, пока из патрона не появится проволока, которую подают в бутыль с бензолом, обезвоженным керосином или трансформаторным маслом, вплотную подставленную к выходному отверстию пресса. Выдавив всю проволоку, поднимают поршень и наливают в патрон этиловый спирт для растворения остатков натрия, а поршень опускают в стакан со спиртом. Затем патрон и поршень промывают спиртом и высушивают патрон в сушильном шкафу, а поршень на воздухе. При длительном контакте с воздухом натриевая проволока покрывается твердой оксидной пленкой и вследствие этого перестает действовать.
Огнеопасные жидкости
Из большой группы огнеопасных жидкостей наибольшую опасность представляют собой органические растворители, образующие при хранении перекисные соединения (простые эфиры, диоксан, тетрагидрофуран). Перегонять и выпаривать подобные жидкости разрешается лишь убедившись предварительно в отсутствии в них перекисей. Но даже при отсутствии перекисей выпаривать досуха подобные вещества не следует.
Горючие жидкости запрещается выливать в канализацию. Отработанные горючие жидкости следует собирать в специальную герметически закрывающуюся тару, которую в конце рабочего дня удаляют из лабораторного помещения для регенерации или сожжения.
Хлорная кислота
Безводная хлорная кислота HClO4 термически неустойчива. Уже при комнатной температуре через несколько часов после приготовления она приобретает окраску, темнеет и, наконец, становится непрозрачной. В этом состоянии хлорная кислота может взорваться. Концентрированная HClO4 (70%) при обычной температуре безопасна в обращении, кипит без опасности взрыва, но если кипящая кислота или ее пары войдут в соприкосновение с органическими или легко окисляющимися неорганическими веществами, взрыв может произойти. Поэтому выпаривать растворы с хлорной кислотой' и ее солями необходимо с добавлением азотной кислоты. Выпаривать следует под сильной вытяжкой. Внутренние стенки вытяжных шкафов, в которых проводится систематическая работа с хлорной кислотой и перхлоратами, необходимо тщательно и часто промывать водой.
Ядовитые вещества
При предварительном определении вещества по запаху не следует наклоняться над сосудом с препаратом и вдыхать пары или газ полной грудью, а только осторожно направлять пары (газ) движением руки к себе.
Все работы, связанные с применением ядовитых веществ, надлежит производить в резиновых перчатках.
Измельчение едких и ядовитых веществ производят в закрытых ступках и под тягой, надев кроме резиновых перчаток еще и предохранительные очки.
Остатки ядовитых веществ следует нейтрализовать соответствующими реагентами (щелочами, хлорактивными веществами и др.), в соответствии с правилами обезвреживания и уничтожения вредных веществ.
Белый фосфор
Хранить белый фосфор следует только под слоем воды.
Все работы с белым фосфором следует проводить в вытяжном шкафу при включенной вентиляции. Аппаратура должна быть герметичной. Работающий должен надеть защитные очки и резиновые перчатки.
В реакционный сосуд фосфор переносят пинцетом. Рабочее место должно быть оборудовано водопроводным краном и бачком для 2% раствора CuSO4 (нейтрализатора).
Метиловый спирт
Применение метилового спирта в лабораторной практике допускается только в тех случаях, когда он не может быть заменен другими, менее токсичными веществами. Работать с ним можно только в вытяжных шкафах, а наливать в емкости сифонами, заряженными вакуумом, или самотеком. Использовать сифоны с засасыванием ртом запрещается.
Пролитый метиловый спирт немедленно смывают большими количествами воды, а освободившуюся из-под него тару немедленно дважды промывают водой.
Для работы в лабораториях необходимо выписывать не более суточной потребности метилового спирта. Когда метиловый спирт израсходован не полностью, остаток следует сдать на склад или закрыть в несгораемый шкаф, который нужно обязательно опечатать. Запрещается передавать метиловый спирт из одной лаборатории в другую. При работе с ним следует руководствоваться «Общими санитарными правилами по хранению и применению метанола».
