Определение pH. Потенциометрия
Понятие о водородном показателе
Вода, являясь очень слабым электролитом, плохо проводит электрический ток, но все же обладает измеримой электропроводностью, которая является результатом ее, пусть незначительной, диссоциации:
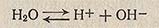
Ионы водорода с молекулами воды образуют гидратированные протоны Н3О+, называемые ионами гидроксония. Однако ради удобства обычно обозначают ионы водорода в виде Н+.
Вода - типично амфотерное соединение: она образует в равных количествах ионы водорода, являющиеся носителями кислотных свойств, и ионы гидроксила - носители щелочных (основных) свойств. Применяя закон действия масс, константу равновесия (диссоциации) можно выразить уравнением:
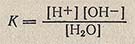
где [Н+] и [ОН-] - концентрация ионов водорода и гидроксила, моль/л.
Поскольку вода в очень малой степени диссоциирует на ионы, то концентрацию молекул воды [Н2O] в момент установления динамического равновесия можно считать постоянной величиной, равной начальной концентрации 1000/18,015 = 55,5 моль/л. В разбавленных водных растворах концентрацию воды можно считать такой же. В этом случае константа электролитической диссоциации воды примет вид:
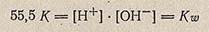
Величина Kw называется ионным произведением воды (константой автопротолиза воды) и является величиной постоянной в воде, разбавленных водных растворах кислот, щелочей, солей и других соединений при постоянной температуре. При 25°С Кw = 1,008 * 10 в минус 14. В идеально чистой воде и в строго нейтральных разбавленных растворах электролитов концентрация водородных ионов равна концентрации гидроксильных ионов: [Н+] = [ОН-].
Отсюда следует, что в нейтральной среде при 25 °С
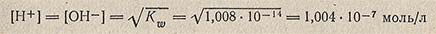
В кислой среде [Н+] > [ОН-], а в щелочной среде, напротив, [ОН-] > [Н+].
Для выражения концентрации водородных ионов была введена величина pH, численно равная отрицательному десятичному логарифму концентрации ионов водорода в единицах нормальности:
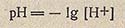
Величина pH получила название водородного показателя.
Однако теория сильных электролитов вводит некоторую поправку в определение pH. Известно, что в водных растворах сильные электролиты полностью диссоциируют, но под влиянием электростатических сил притяжения и отталкивания происходит интенсивное влияние противоположно заряженных ионов. Это взаимное влияние тем сильнее, чем выше концентрация ионов. В этих условиях реакция среды определяется эффективной концентрацией ионов, так называемой активностью ионов.
Активность ионов водорода аH+ - это величина концентрации ионов Н+, уменьшенная под влиянием взаимодействия этих ионов в растворе:
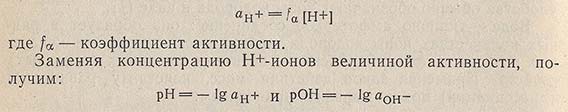
Повышение активности ионов водорода приводит соответственно к понижению активности ионов гидроксила, так как произведение этих активностей должно быть постоянной величиной при данной температуре. Чтобы упростить вычисления, часто не учитывают коэффициенты активности. Для разбавленных растворов вводимая при этом погрешность не очень велика.

Колориметрическое определение pH
Колориметрический метод определения pH растворов основан на свойстве кислотно-основных индикаторов изменять свою окраску в зависимости от активности ионов водорода в определенном интервале pH. Колориметрическое определение pH производят путем сравнения окраски испытуемого раствора и ряда буферных растворов (растворов со строго определенной величиной pH) при одном и том же содержании индикатора. Но вначале определяют приближенную величину pH испытуемого раствора с помощью индикаторных бумажек, или последовательного ряда индивидуальных или универсальных индикаторов.
Индикаторные бумаги
Индикаторные бумаги представляют собой полоски хроматографической бумаги, пропитанные индивидуальными или смешанными кислотно-основными индикаторами («универсальные»), Определять pH при помощи индикаторной бумаги возможно только в растворах с не очень высокой концентрацией солей и в отсутствие сильных окислителей.
Индикаторная бумага выпускается в виде книжечек по 100 полосок; она очень чувствительна к свету, влажности и действию паров веществ кислотного или основного характера. При правильном хранении индикаторные бумаги не теряют химических свойств в течение 2-4 лет.
Для определения pH полоску реактивной бумаги на несколько секунд погружают в испытуемый раствор, либо наносят испытуемый раствор на бумагу стеклянной палочкой, либо прикладывают полоску бумаги к влажной пробе.
В табл. 9 приведены данные об отечественных индикаторных бумагах.
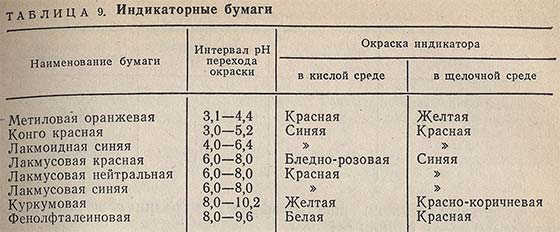
Более широкое распространение получили универсальные индикаторные бумаги. Они представляют собой полоски хромато-графической бумаги, пропитанные смесью кислотно-основных индикаторов с разными интервалами перехода окраски. При изменении значения pH в широких пределах происходят заметные на глаз изменения окраски бумажек.
Универсальная индикаторная бумага «Рифан» предназначена для определения pH воды и водных растворов в пределах pH = 1,0-10. Она представляет собой листочки хроматографической бумаги размером 10x85 мм, на которые нанесены цветная полоса индикатора и цветные полосы, служащие шкалой для сравнения.
Для определения pH листочек бумаги погружают в испытуемый раствор так, чтобы все цветные полосы были одинаково смочены жидкостью. Затем его извлекают и немедленно сравнивают цвет индикаторной полосы (средняя без цифр) с цветной шкалой на полоске бумаги, имеющей цифровые обозначения pH. Тождественность окраски индикаторной полосы с маркированной полосой цветной шкалы указывает величину pH.
Индикаторная бумага «Рифан» позволяет с достаточной точностью оценить значения pH водных растворов и суспензий, так как отдельные ступени шкалы выражают разницу в основном значении 0,3-0,4 единиц pH.
Индикаторная бумага «Фан» (Phan), поставляемая Чехословакией, позволяет еще с большей точностью определять величины pH в интервале 1-14.
Растворы индикаторов
Для ориентировочной оценки значения pH можно также непосредственно применить индивидуальные или смешанные (универсальные) индикаторы.
К отдельным пробам испытуемого раствора (5-10 мл) прибавляют по 1-2 капли каждого из индивидуальных индикаторов, указанных в табл. 10.
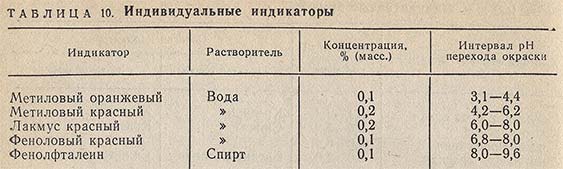
По изменению окраски судят о приближенном значении pH.
Приводим состав и способ приготовления одного из универсальных индикаторов. В 50 мл 96% этилового спирта растворяют 0,01 г фенолфталеина, 0,02 г метилового красного, 0,03 г метилового желтого, 0,04 г бромтимолового синего, 0,05 г тимолового синего. К полученному раствору добавляют 0,1 н. раствор NaOH до появления желтой окраски.
К 1 мл испытуемого раствора добавляют 1 каплю универсального индикатора и наблюдают изменение окраски: красная - pH = 2; оранжевая – pH = 4,0; желтая - pH = 6,0; зеленая - pH = 8; синяя - pH = 10.
Буферные растворы
Буфер - это соединение или смесь веществ, введение которых в раствор способствует поддержанию постоянного значения pH. Буферный раствор препятствует изменению pH, которое может происходить при разбавлении раствора или добавлении к нему сильной кислоты или сильного основания.
Буферные растворы, однако, сохраняют постоянство pH лишь до прибавления некоторого определенного количества кислоты (или щелочи). Если концентрация добавленной кислоты (щелочи) превышает предел буферной емкости данного раствора, то pH резко изменяется.
За единицу буферной емкости условно принимают емкость такого раствора, для изменения pH которого на единицу требуется введение 1 эквивалента сильной кислоты (щелочи) на 1 литр.
Буферная емкость зависит от концентрации компонентов буферного раствора. Чем раствор концентрированнее, тем больше его буферная емкость. Разбавление буферного раствора не влияет заметно на изменение pH, но значительно отражается на буферной емкости.
Буферные растворы используются в качестве рН-стандартов для калибровки рН-метров, для колориметрического определения pH и других целей.
Изготовляют буферные растворы из реактивов, выпускаемых специально для рН-метрии. В соответствии с ГОСТ 10170-62, шкала pH основана на воспроизводимых значениях pH пяти образцовых (реперных) буферных растворов (табл. 11). Они выпускаются в виде стандарт-титров (ампул), рассчитанных на приготовление 1000 мл буферного раствора каждого наименования.
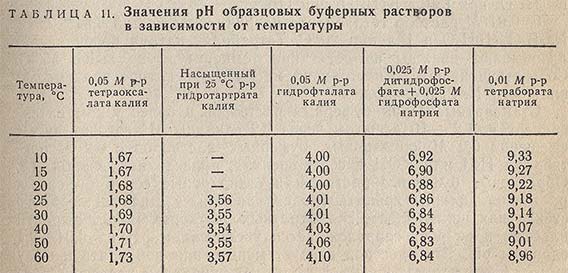
Кроме пяти образцовых буферных растворов, можно использовать также 0,1 н. раствор НСl, значение pH которого равно 1,10 в диапазоне температур 0-50 °С.
При отсутствии стандарт-титров для рН-метрии можно готовить образцовые буферные растворы из реактивов квалификации х.ч. или ч.д.а. следующим образом.
1. 0,05 М раствор тетраоксалата калия, содержащий 12,7 ±0,02 г КНС2O4-Н2С2O4-2Н2O в 1 л при 20 °С. Тетраоксалат калия перекристаллизовывают дважды из воды и сушат на воздухе при температуре не выше 58 °С.
2. Насыщенный при 25 °С раствор гидротартрата калия. Тонко измельченный КНС4Н4О6 встряхивают некоторое время с дистиллированной водой при 25 °С. Не растворившуюся часть кристаллов отфильтровывают.
3. 0,05 М раствор гидрофталата калия, содержащий 10,21 г КНС8Н4O4 в 1 л; 0,2 М раствор - 40,846 г КНС8Н4O4 в 1 л при 20 °С. Гидрофталат калия перекристаллизовывают дважды из воды и сушат при 110 ±5°С.
4. 0,025 М раствор дигидрофосфата калия и 0,025 М раствор гидрофосфата натрия, содержащий 3,40 ±0,01 г КН2РO4 и 3,65 ±0,01 г Na2HPO4 в 1 л при 20 °С. Оба реактива дважды перекристаллизовывают из воды и сушат до постоянной массы: Na2HPO4 при 130, а КН2РO4 при 110°С.
5. 0,01 М раствор тетрабората натрия, содержащий 3,81 ±0,01 г Na2B4O7-10Н2O в 1 л при 20°С. Тетраборат натрия перекристаллизовывают дважды из воды при температуре не выше 55 °С. Соль высушивают до постоянной массы в эксикаторе над смесью влажного NaCl и сахара.
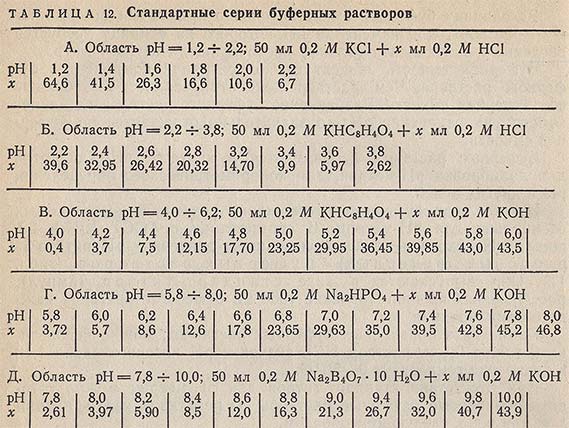
Стандартные серии буферных растворов в более узком интервале pH = 1,2-10 с шагом через 0,2 единицы pH готовят путем смешения 0,2 М образцовых буферных растворов с 0,2 М растворами НСl или КОН в соотношениях, приведенных в табл. 12. Образцовые буферные растворы и стандартные серии буферных растворов должны храниться в склянках из химически стойкого стекла или полиэтилена. В тартратных растворах может вырасти плесень, и ее рост сопровождается увеличением pH на 0,01-0,1 единицы pH. Этот раствор следует менять или добавлять к нему тимол (6-8 кристаллов на 1л), предохраняющий раствор от заплесневения на срок до двух месяцев. Остальные буферные растворы устойчивы в течение месяца. Хранение буферных растворов в холодильнике значительно удлиняет срок их годности.
Методы и средства колориметрического определения pH
Колориметрическое определение pH водных растворов обычно основывается на предположении, что pH двух одинаково окрашенных индикатором растворов равны, если активность ионов водорода и температура обоих растворов одинаковы. Буферные стандартные растворы должны иметь приблизительно ту же ионную силу, что и исследуемые растворы.
При измерении pH в неводных средах и смешанных растворителях (водно-спиртовые, водно-ацетоновые растворы) следует иметь в виду, что измерения, сделанные в сравнении с водными стандартными буферными растворами, имеют только относительное значение в связи с изменением интервалов перехода окраски индикаторов и изменением pH нейтральной точки.
Для определения pH воды и разбавленных водных растворов колориметрическим методом выпускаются специальные наборы и аппараты, в частности аппараты Михаэлиса: ММ-1 для проб объемом 0,5 мл; ММ-2 - для проб объемом 5 мл. Индикаторами служат: а-динитрофенол (pH = 2,8-4,4); гамма-динитрофенол (pH = 4,0-5,4); n-динитрофенол (pH = 5,4-7,0) и m-динитрофенол (pH = 6,8-8,4), а также универсальный индикатор для предварительного определения pH в пределах 3-8. К универсальному индикатору прилагается цветная шкала. Каждому индикатору соответствует серия окрашенных буферных растворов, причем pH каждого раствора отличается от предыдущего на 0,2 единицы pH.
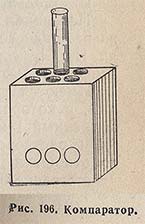
При определении pH слабоокрашенных водных растворов используется принцип сложения окраски раствора сравнения с собственной окраской испытуемого раствора. Для этой цели в комплект прибора включен компаратор (рис. 196). Он представляет собой деревянный брусок, в котором сделаны три пары параллельных углублений, достаточно широких, чтобы вставить туда пробирки. Перпендикулярно этим углублениям проходят три канала меньшего диаметра, которые пересекают насквозь стенки каждой пары широких углублений. Через эти каналы можно наблюдать пробирки с содержимым в проходящем свете. Стенки углублений и каналов окрашены в неотражающий черный цвет. В одно из центральных углублений помещают пробирку с испытуемым раствором плюс индикатор, а в другое - с дистиллированной водой. В передние боковые углубления помещают пробирки с буферными растворами плюс индикатор, а позади них - пробирки, наполненные только окрашенным или мутным испытуемым раствором. Сравнение окрасок производят на фоне экрана из молочного стекла. Если окраска испытуемого раствора совпадает с окраской какого-либо эталона, то значение pH испытуемого раствора то же самое, что и эталона (буферного раствора). Если нет эталона с совпадающей окраской, то подбирают два эталона, окрашенных несколько сильнее и слабее, чем испытуемый раствор. Величину pH находят как среднее между этими двумя эталонами.
Потенциометрия
Потенциометрия - электрохимический метод анализа, заключающийся в измерении электродного потенциала и нахождении зависимости между его величиной и концентрацией (точнее, активностью) потенциалоопределяющего компонента в растворе. Потенциал всякого электрода можно измерить только по отношению к какому-либо постоянному потенциалу другого электрода.
Поэтому необходимо составить гальванический элемент (электролитическую ячейку) из двух полуэлементов с электродами, между которыми возникает разность потенциалов. Потенциал одного электрода (электрод сравнения, вспомогательный электрод) постоянен и заранее известен. Потенциал другого электрода (индикаторный, измерительный электрод) зависит от активности (концентрации) ионов водорода. Электродвижущая сила (э.д.с.), возникающая между электродами, равна алгебраической разности между их потенциалами.
Электроды для потенциометрии
В качестве стандартного электрода сравнения повсеместно принят нормальный водородный электрод, потенциал которого условно приравнен нулю при любой температуре и при давлении газообразного водорода 1013 гПа (760 мм рт. ст.). Однако из-за трудоемкости приготовления водородного электрода и необходимости соблюдать постоянство концентрации ионов водорода в процессе измерения pH на практике используют другие электроды сравнения.
Наиболее распространенными электродами сравнения являются каломельный и проточный хлорсеребряный электроды.
Потенциал каломельного электрода, который состоит из небольшого количества ртути, покрытой тонким слоем каломели Hg2Cl2 и погруженной в раствор хлорида калия (рис. 197), зависит только от концентрации хлорида калия и температуры.
Имеются три различных каломельных электрода: насыщенный, в котором водный раствор насыщен КСl; нормальный - заполненный 1 н. раствором КСl, и децинормальный - заполненный 0,1 н. раствором КСl. При 20 °С потенциалы этих трех электродов по отношению к нормальному водородному электроду равны соответственно 0,2444, 0,2815 и 0,3340 В.
Хлорсеребряный электрод сравнения аналогичен каломельному, только вместо металлической ртути в нем используется металлическое серебро, а вместо каломели - хлорид серебра. Если используется насыщенный раствор КС1, то потенциал хлор-серебряного электрода при 25 °С равен 0,1988 В. Потенциал отечественных хлорсеребряных электродов сравнения ЭВЛ-1М3, ЭВЛ-1М1, ЭХСВ-1 относительно нормального водородного электрода при 20 °С равен 0,201 ±0,003 В.
Электрод сравнения соединяют с измерительными электродами через электролитический ключ-трубку, заполненную насыщенным раствором КСl и заканчивающуюся пористой перегородкой.
Возникшую между электродами э.д.с. можно измерить различными способами. Наибольшее распространение получил метод непосредственного измерения с помощью рН-метров (прямая потенциометрия).
В качестве индикаторных электродов используют различные электроды, потенциал которых является функцией активности ионов водорода. Практически чаще всего используют стеклянные мембранные электроды.
На рис. 198 показан один из таких электродов. Тонкостенная колба из специального стекла, обладающего высокой чувствительностью к активности ионов водорода в растворе, прикреплена к нижней части стеклянной трубки. Внутри колбы находится 0,1 М раствор соляной кислоты. В него погружена серебряная проволока, покрытая слоем AgCl. Проволока проходит через трубку, заполненную смолой; ее верхний конец обеспечивает контакт с внешней цепью.

Потенциал стеклянного электрода представляет собой разность потенциалов на обеих сторонах стеклянной мембраны. Он зависит только от активности ионов водорода в растворе и в широкой области pH не зависит от присутствия в растворе других ионов.
Преимущества стеклянного электрода таковы: наблюдаемые э.д.с., измеренные по отношению к электроду сравнения, не подвержены влиянию присутствующих окислителей или восстановителей; электрод можно применять в окрашенных, мутных или коллоидных растворах; время установления равновесного потенциала измеряется долей минуты; точные результаты могут быть получены при пользовании им в незабуференных растворах, так как ток, проходящий через цепь, крайне незначителен; измерение pH можно проводить в небольшом объеме жидкости.
Однако стеклянные электроды очень хрупки, чувствительны к щелочным растворам; кроме того, из-за неодинаковых свойств внутренней и внешней поверхности стекла мембраны возникают также потенциалы, отличающиеся друг от друга. Эта разность потенциалов носит название потенциала асимметрии. В случае тонкостенных электродов из мягкого стекла потенциал асимметрии может составлять несколько милливольт, а в случае толстостенных электродов из тугоплавкого стекла - десятки милливольт. Для уменьшения потенциала асимметрии стеклянный электрод вымачивают и хранят в воде или в 0,1 н. растворе НСl.
Стеклянные электроды, обладающие высокой избирательностью (селективностью) по отношению к каким-либо ионам, называют электродами с электродной функцией по данному виду ионов. Изменяя состав стекла, из которого изготовляется нижняя часть электрода, получают ионоселективные солевые мембранные индикаторные электроды, избирательно реагирующие на изменение активности катионов (К+, Na+, Ag+, NH4+ и др.).
При изготовлении анионоселективных электродов в твердый материал, который запрессовывают в нижнюю часть стеклянной трубки, вводят нерастворимое соединение, содержащее ионы, которые нужно определять (F-, Cl-, Br-, I-, S2-).
Приборы для прямой потенциометрии
Методы прямой потенциометрии основаны на определении активности (концентрации) отдельных веществ - участников электродной реакции по экспериментально измеренной э.д.с. цепи или потенциалу индикаторного (измерительного) электрода.
Наиболее широкое применение метод прямой потенциометрии находит для определения активности ионов водорода (pH растворов), а также различных катионов и анионов с использованием ионоселективных мембранных электродов.
При потенциометрическом определении pH используются приборы (рН-метры, ионометры), устройство которых позволяет непосредственно получать величины pH и рХ, где рХ - отрицательный десятичный логарифм активности (концентрации) анализируемого катиона или аниона. Эти приборы позволяют также измерять окислительно-восстановительные потенциалы растворов.
Для измерения окислительно-восстановительных потенциалов, выражаемых в вольтах или милливольтах, применяют платиновый индикаторный электрод и хлорсеребряный электрод сравнения. Для измерения активности (концентрации) одно- и двухвалентных катионов и анионов в растворах используют электродную систему из ионоселективных мембранных измерительных электродов, хлор-серебряных электродов сравнения и измерительного преобразователя.
Промышленность выпускает рН-метры двух основных типов: нулевого (потенциометры) и с прямым отсчетом (ламповые вольтметры). В последние годы рН-метры со стеклянным измерительным электродом и непосредственным отсчетом результатов измерений получили наибольшее распространение.
Стеклянные электроды имеют очень высокое электрическое сопротивление. По этой причине измерение pH и другие потенциометрические измерения с помощью стеклянных электродов проводятся с использованием электронных приборов, специально предназначенных для таких высоких сопротивлений. Потенциал стеклянного электрода накладывается на сетку электрометрической электронной лампы с высоким сопротивлением, а электрод сравнения соединяется с катодом этой лампы. Увеличение силы тока в лампе регистрируется измерительным прибором, откалиброванным в единицах pH.
Все рН-метры требуют периодической настройки. Для этого измерительный электрод и электрод сравнения погружают в буферный раствор с точно известным pH и регулируют прибор таким образом, чтобы стрелка измерительного прибора показывала точное значение pH буфера. В первые несколько дней эксплуатации прибора или нового стеклянного электрода настройку рН-метра следует производить по буферным или контрольным растворам каждый день. При последующей работе с прибором настройку можно производить один раз в три дня.
При температуре исследуемого раствора 0-40°С настройку прибора производят по буферным растворам с 20 и 50 °С, а при 15-100° температура буферного раствора должна быть 20 и 80 °С. Значения pH при этом должны составлять:
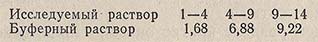
Электроды перед погружением в буферный или контрольный раствор необходимо тщательно промыть дистиллированной водой, а остатки воды с них удалить фильтровальной бумагой.
Измерения, проводимые с помощью ионоселективных электродов, требуют построения калибровочного графика, выражающего зависимость измеряемого потенциала от активности анализируемых ионов в стандартных условиях.
Если концентрация посторонних ионов в исследуемом растворе мала, на графике можно откладывать концентрацию выбранных ионов, а не их активность.
Электродвижущая сила электродных систем, применяемых для измерений pH, зависит от температуры. Современные рН-метры снабжены температурным компенсатором, устанавливаемым вручную или автоматически. С помощью температурной компенсации в рН-метре устраняются изменения э. д. с. в зависимости от температуры.
Элементарная схема, поясняющая общий принцип действия рН-метра, приведена на рис. 199. Электродвижущая сила Ех, развиваемая электродной системой, сравнивается с падением напряжения на сопротивлении R, через которое протекает ток Iвых оконечного каскада усилителя. Падение напряжения Uвых на сопротивления R противоположно по знаку электродвижущей силе Ех, и на вход усилителя подается напряжение Uвх = Eх - Uвых = Ех – Iвых R. Напряжение Uвх преобразуется в переменное напряжение, которое затем многократно усиливается и вновь преобразуется в постоянное. Это напряжение управляет током Iвых оконечного каскада усилителя. При достаточно большом коэффициенте усиления напряжение Uвых мало отличается от э.д.с. Ех, и благодаря этому ток, протекающий через электроды в процессе измерения э.д.с., весьма мал. Ток Iвых, протекающий через сопротивление R, пропорционален э.д.с. электродной системы, т.е. pH анализируемого раствора.
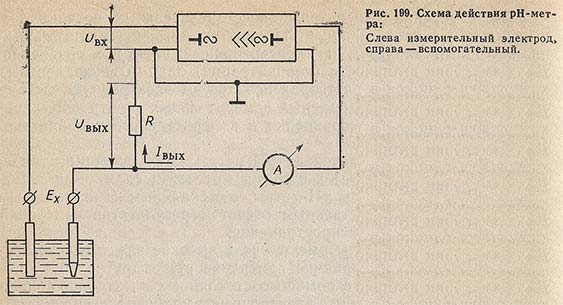
Устройство, подготовка к работе и порядок работы на различных рН-метрах излагаются в прилагаемых к этим приборам инструкциях и паспортах.
В настоящем разделе кратко описаны лишь некоторые лабораторные рН-метры, выпускаемые в настоящее время промышленностью.
Лабораторный рН-метр - милливольтметр рН-121. Показывающий прибор, градуированный в единицах pH и милливольтах, для определения величин pH, pNa, pAg, рК, pNH4 и окислительно-восстановительных потенциалов; может также использоваться в качестве высокоомного нуль-индикатора и милливольтметра. Его можно использовать для ручного и автоматического потенциометрического титрования (с блоком автоматического титрования БАТ-15). С его помощью можно производить измерения как методом отбора проб с использованием прилагаемой к прибору термостатированной ячейки или ячейки для микроизмерений, так и непосредственно в лабораторных установках.
Пределы измерения величины pH - от 1 до 14 с диапазонами 1-14; 1-4; 4-9; 9-14. Основная погрешность измерений 0,05 единицы pH.
Температурная компенсация ручная и автоматическая от 0 до 100 °С. Питание от сети переменного тока напряжением 220 В. Усилитель постоянного напряжения питается от полупроводникового стабилизатора напряжения компенсационного типа на полупроводниковых элементах. Для питания измерительной схемы в блоке питания имеются два стабилизированных источника питания, имеющие малый коэффициент пульсации.
Электродом сравнения в приборе рН-121 служит проточный хлорсеребряный электрод ЭВЛ-1МЗ, один для всех видов потенциометрических измерений. Его потенциал при 20 °С равен 202 ±2 мВ; область рабочей температуры 0-100 °С. Гарантийный срок хранения и эксплуатации электрода 18 месяцев. Электрод хранят закрытым пробкой и колпачком или погруженным в насыщенный раствор КСl.
В качестве индикаторного электрода для измерения величины pH служат стеклянные электроды ЭСЛ-43-07 и ЭСЛ-63-07. Диапазон прямолинейной водородной характеристики электрода ЭСЛ-43-07 при 25 °С от 0 до 12 pH, а при наибольшей рабочей температуре (40 °С) от 0 до 10 pH. Поэтому этим электродом следует пользоваться для измерений pH в пределах 0-10 pH при температуре анализируемой среды от 0 до +40°С.
Электрод ЭСЛ-63-07 используется для измерений pH в пределах 0-14 единиц, при температуре анализируемой среды от +25 до +100 °С.
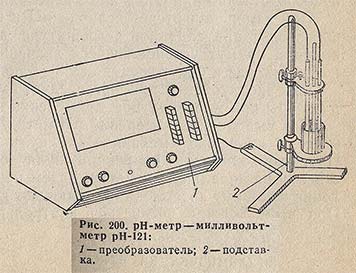
рН-метр - милливольтметр состоит из преобразователя и подставки (рис. 200). На лицевой панели преобразователя (прибора) располагаются органы управления, показывающий прибор и органы заводской настройки и регулировки. На шкале показывающего прибора имеются оцифровки, соответствующие диапазонам измерения pH (э.д.с.). Блок измерения прибора обеспечивает его настройку для работ на различных диапазонах измерения и коррекцию показаний при изменении температуры исследуемого раствора от 0 до + 100 °С. Подставка предназначена для крепления электродов и установки сосудов с анализируемым или буферным раствором. При необходимости на подставке укрепляется также электромагнитная мешалка, органы управления которой (тумблер включения, ручка регулирования скорости и направления вращения) вынесены на переднюю панель прибора. На подставке закреплены два кронштейна. Высота их установки может регулироваться в зависимости от вида измерений - в стакане, в термостатированной ячейке или в ячейке для измерений pH в малом объеме раствора.
Термостатированная ячейка представляет собой пластмассовый стакан со штуцерами, к которым подсоединяются резиновые шланги от лабораторного ультратермостата. В термостатируемую ячейку устанавливается внутренний стеклянный стакан с контролируемым раствором.
Ячейка для микро измерений представляет собой стакан с крышкой, в которой имеются три отверстия: для установки вспомогательного электрода, термометра и электрического ключа. Стакан заполняется насыщенным раствором KCl. Электролитический ключ имеет форму цилиндра со сферическим дном. Впаянная в нижней части асбестовая нить обеспечивает связь полой части ключа с раствором KCl в стакане. В электролитический ключ помещают контролируемый раствор (1-2 мл) и чувствительный элемент измерительного электрода. При этом следует отрегулировать положение электродов, чтобы измерительный электрод прилегал к внутренней сферической поверхности электролитического ключа, а вспомогательный был погружен в раствор KCl на 30-40 мм.
При измерении pH растворов в стакане или в термостатированной ячейке нижний конец электрода сравнения должен быть погружен на несколько миллиметров ниже, чем измерительный стеклянный электрод, во избежание удара последнего о дно стакана. На одном из кронштейнов закрепляют держатели с отверстиями для установки электродов, термометра и автоматического термокомпенсатора. На штативе имеется винт заземления; при эксплуатации прибора он должен быть соединен с зажимом заземления на задней панели прибора. В зависимости от вида и условий измерений pH следует выбрать необходимые электроды. Измерительные электроды подключают к гнездам с надписью «изм» на панели прибора непосредственно или с помощью переходного штекера.
При измерении отсчет величин pH, и э.д.с. по шкале прибора производят при заданной температуре, после того как показания прибора примут установившееся значение. Измерение производят несколько раз и берут среднее из 3-5 показаний.
При эксплуатации прибора следует иметь в виду, что буферные растворы при многократном применении могут менять pH.
Для выполнения измерений рН-метр устанавливают на рабочем месте и проверяют механический нуль показывающего прибора. При необходимости коррекции нуля отверткой устанавливают стрелку на начальную отметку. Затем присоединяют провод заземления к зажиму заземления и включают прибор в сеть 220 В, 50 Гц. При этом должна загореться контрольная лампочка на панели прибора. Прибору дают прогреться в течение 25-30 мин и ручкой с надписью «Температура раствора» устанавливают значение температуры контролируемого раствора. После этого корректируют шкалу pH прибора по стандартным буферным растворам (включая 0,1 н. раствор HCl). Для этого в стакан или термостатируемую ячейку наливают стандартный буферный раствор, опускают в него измерительный стеклянный электрод и хлорсеребряный электрод сравнения и переключателем устанавливают показывающий прибор на соответствующий диапазон измерений. Затем ручкой потенциометра «Калибровка» устанавливают стрелку показывающего прибора на деление шкалы, отвечающее значению pH стандартного буферного раствора при данной температуре. По окончании калибровки выключают прибор (контрольная лампочка гаснет) и отключают его от сети. Электроды осторожно вынимают, промывают дистиллированной водой и оставляют погруженными в 0,1 н. HCl - измерительный электрод и в насыщенный раствор KCl - электрод сравнения.
При измерении pH помещают электроды в сосуд с испытуемым раствором, присоединяют их к соответствующим клеммам, устанавливают автокомпенсатор температуры, включают прибор в сеть и спустя 25-30 мин отмечают показания стрелки по шкале 1-14. Далее устанавливают переключатель на соответствующий диапазон измерений и производят отсчет показаний прибора.
Переносный портативный специализированный прибор рН-222. Предназначен для контроля кислотности молока и молочных продуктов в лабораторных и цеховых условиях.
Измерение э.д.с. электродной системы производится с помощью высокоомного усилителя постоянного тока, выполненного на электрометрических лампах и транзисторах. Питание прибора осуществляется от аккумуляторов или сухого элемента «Сатурн». Для подзарядки аккумуляторов в комплекте прибора имеется зарядное устройство. От других рН-метров отличается наличием специальной температурной компенсации, благодаря которой показания его не изменяются при изменении температуры исследуемого продукта и соответствуют значению pH при 20 °С. Настройка производится по одному фосфатному буферному раствору (pH = 6,88) при 20°С.
Пределы измерения pH 3-8; диапазоны 3-4, 4-5, 6-7, 7-8. Погрешность измерения ±0,03-0,05 единиц pH. Выбор необходимого диапазона измерения осуществляется переключателем, расположенным на лицевой панели прибора.
В комплект рН-метра кроме обычных стеклянных электродов (с шарообразной мембраной) входят копьевидные электроды для измерения pH вязких продуктов.
Потенциометрическое титрование
Потенциометрическое титрование основано на определении точки эквивалентности в реакциях нейтрализации, окисления-восстановления, осаждения и в комплексообразовании по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода.
В объемном (титриметрическом) анализе неизвестное количество вещества в контролируемом растворе определяют по расходу титрующего раствора (титранта). Объем израсходованного титранта точно известной концентрации позволяет рассчитать количество определяемого вещества в том случае, когда точно установлена эквивалентная точка титрования (окончание реакции). Конечную точку титрования фиксируют либо визуально (по изменению окраски добавленного индикатора, появлению мути и т. п.), либо измерением физико-химических свойств титриметрической системы (изменение потенциала электродной системы, проводимости, оптических свойств и т. п.).
Для потенциометрического титрования собирают цепь из индикаторного электрода и электрода сравнения в анализируемом растворе. Титр ант приливают из бюретки порциями при непрерывном перемешивании. После добавления каждой порции титранта выдерживают 1-2 мин и измеряют э.д.с. цепи.
В начале титрования титрант добавляют относительно большими порциями, в конце титрования - по 0,1 и 0,05 мл.
Вблизи точки эквивалентности (конечной точки титрования) наблюдается наибольшее изменение электродного потенциала (скачок потенциала).
Еще более резко изменяется отношение изменения потенциала dЕ к соответствующему изменению объема титранта dV. Точку эквивалентности обычно определяют по максимальному значению величины dE/dV.
В табл. 13 в качестве примера представлены результаты титрования 50 мл 0,1 н. раствора HCl 0,1 н. раствором NaOH.
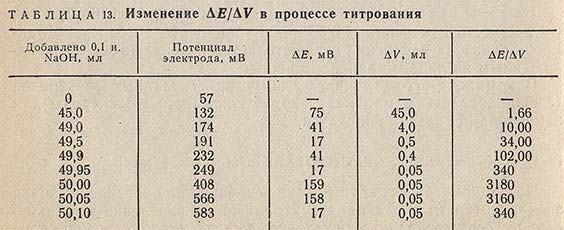
Величина скачка в эквивалентной точке при потенциометрическом титровании кислот и оснований зависит от силы кислоты и основания, а также от концентрации раствора. С уменьшением силы кислоты (основания) и концентрации раствора скачок уменьшается.
Для нахождения эквивалентной точки титрования строят график в координатах dE/dV - V. При титровании смеси кислот различной силы появится несколько скачков.
При титровании определенного объема раствора V1 неизвестной концентрации содержание вещества в растворе, выраженное в эквивалентах на литр, легко вычислить по формуле:
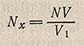
где N - нормальность и V - объем титранта; Nx - нормальность и V1 - объем испытуемого раствора.
Потенциометрическое титрование в лабораторных условиях можно проводить вручную, с использованием любого типа рН-метра и обычных бюреток, а также с помощью полуавтоматических титраторов, автоматически прекращающих подачу титранта к моменту окончания титрования. При использовании титраторов все подготовительные операции для анализа проводятся вручную.
Для полуавтоматического титрования выпускаются также титрографы - лабораторные приборы, автоматически регистрирующие на диаграмме всю кривую титрования в выбранных координатах.
Выпускается также специальное электронное регистрирующее устройство - блок автоматического титрования БАТ-15. В комплексе со специальной бюреткой и рН-метром-милливольтметром типа рН-121 оно составляет установку для полуавтоматического титрования.
Специальная бюретка-дозатор служит для автоматического прибавления титранта в контролируемый раствор с регулярной скоростью и автоматической остановкой в точке эквивалентности.
Принцип действия установки заключается в следующем. Напряжение, пропорциональное э.д.с. электродной системы, с выхода рН-метра-милливольтметра подается на вход БАТ-15, где сравнивается с напряжением, установленным на датчике конечной точки титрования. Разность этих напряжений поступает на вход усилителя. На его выходе включено бесконтактное электронное реле, управляющее работой электромагнитного клапана. При открытом клапане титрующий раствор подается в ячейку, в которой перемешивание осуществляется магнитной мешалкой. При равенстве напряжений реле отключает питание клапана, который, закрываясь, пережимает резиновую трубку и прекращает подачу титрующего раствора. Прибор имеет реле времени выдержки от 0 до 40 с. Относительная погрешность метода не превышает ±1%. Питание прибора от сети переменного тока напряжением 220 В.
