Синтез газов
Синтез газов осуществляют взаимодействием твердого вещества с жидкостью, взаимодействием двух жидких веществ или термическим разложением вещества.
Качество синтезируемых газов зависит от чистоты исходных веществ, а также от формы и размеров применяемых приборов. Форму и размеры приборов обычно выбирают в зависимости от характера реакций, лежащих в основе метода получения газа, требуемого количества газа и степени его чистоты.
Приборы для получения газов должны быть изготовлены из термически и химически устойчивых сортов стекла. Необходимо, чтобы соединения отдельных частей были герметичны; по возможности следует избегать соединений резиновыми или пластмассовыми трубками.
Одно из основных требований при выборе прибора - минимальная величина «вредных» объемов, из-за которых необходимо долго пропускать через прибор получаемый газ для удаления из него воздуха.
Удобен и весьма универсален лабораторный прибор для получения газов, образующихся при взаимодействии жидкостей с твердыми веществами (Н2, СO2, H2S) - стеклянный аппарат Киппа (рис. 147). Твердое вещество в реакторе 4 помещается на вкладыше 5 из винипласта; вкладыш имеет три отверстия диаметром 1,5-2 мм для стекания жидкости из реактора в нижнюю часть аппарата. Тубус реактора, служащий для отвода выделяющегося газа, соединен с краном отводной трубки 2.
Аппараты Киппа выпускаются вместимостью (по шару реактора) 500, 1000 и 2000 мл из толстостенного стекла ТХС1 или ТХС2.
Для подготовки аппарата к работе вынимают резиновую пробку 3 из тубуса реактора 4 и вводят в реактор кусочки твердого реагента, например, мрамора (объем реагента не должен превышать 2/5 объема реактора). Пользоваться порошком не рекомендуется, так как в этом случае газ выделяется бурно и возможен его прорыв через воронку 1 аппарата. Затем пробку 3 вставляют в тубус реактора и при открытом кране отводной трубки 2 через воронку 1 наливают жидкость (например, разбавленный раствор НСl) в таком количестве, чтобы реактор был заполнен наполовину. Образующийся газ пропускают через отводную трубку в течение 7-10 мин для вытеснения воздуха из аппарата. При закрытом кране отводной трубки 2 выделяющийся газ выталкивает жидкость через нижнюю часть аппарата в воронку 1; при этом жидкость не контактирует с твердым веществом и газ не выделяется. При получении агрессивных или дурно пахнущих газов воронку 1 закрывают жидкостным затвором с нейтрализующим раствором. По окончании промывания аппарата выделяющимся газом газоотводную трубку с краном 2 соединяют с тем прибором, в который требуется пропускать газ.
Аппарат периодически очищают. Для этого осторожно при закрытом кране отводной трубки вынимают стеклянную пробку 6 и через нижний тубус сливают жидкость в заранее подготовленный сосуд, приоткрывая кран отводной трубки. Затем споласкивают аппарат водой, которую наливают через воронку 1.
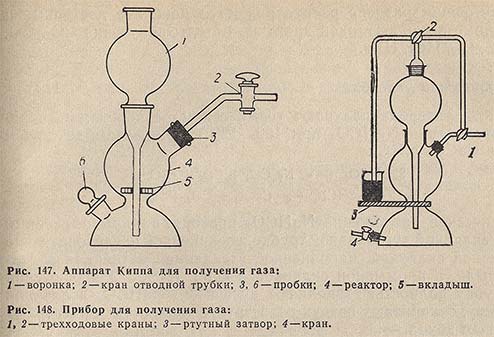
Несколько изменив аппарат, можно получить газ, практически не загрязненный воздухом. В приборе (рис. 148) предусмотрено соединение среднего и верхнего шаров трубкой с двумя трехходовыми кранами 1 и 2. Это простое приспособление позволяет, при установившейся работе прибора, заполнять все три шара чистым газом. При соответствующих положениях кранов 1 и 2 можно отбирать газ как из среднего, так и из верхнего шара. Для регулирования давления в приборе служит ртутный затвор 3. В средний шар загружают кусочки твердого вещества и из прибора полностью удаляют воздух, заполняя прибор и трубки свежепрокипяченной водой. Затем кран 4 соединяют с сосудом, содержащим жидкий реагент, и с помощью водоструйного насоса, присоединенного к трубке крана 1, отсасывают воду из среднего шара до тех пор, пока уровень жидкости в нижнем шаре не достигнет твердого реагента; при этом выделяется газ. Далее переключают краны и отсасывают воду из верхнего шара, пока жидкость не поднимется до половины объема шара. Снова переключают краны и засасывают жидкий реагент в средний шар; при этом газ начинает бурно выделяться. Краны переключают так, чтобы жидкость, вытесняемая газом, выливалась через ртутный затвор. Затем, пользуясь обоими кранами, регулируют давление газа в приборе.
В настоящем разделе рассматриваются наиболее доступные и проверенные в лабораторной практике методы получения СO2, СО, SO2, H2S, Cl2, НСl, HBr.
Синтез диоксида углерода
Диоксид углерода получают термическим разложением гидрокарбоната натрия NaHCO3 при 100-120 °С или взаимодействием мрамора CaCO3 с НСl:
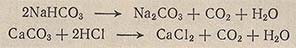
Термическое разложение NaHCO3 проводят в закрытой с одного конца стеклянной тугоплавкой трубке, соединенной последовательно с промывной склянкой, наполненной стеклянной ватой для задержания пыли, и промывной склянкой с конц. H2SO4 для осушения СO2. Трубку полностью заполняют кусочками NaHCO3 величиной с горошину, откачивают воздух водоструйным насосом и нагревают с закрытого конца.
Получение СO2 взаимодействием мрамора с НСl (1 об. ч. НСl (р = 1,19 г/см3) и 1 об. ч. дистиллированной воды) проводят в аппарате Киппа.
Небольшие кусочки мрамора предварительно очищают. Для этого мрамор помещают в фарфоровую чашку, заливают разбавленной НСl (1:2), перемешивают 5-10 мин, сливают кислоту, ополаскивают мрамор водой и кипятят в течение нескольких часов в дистиллированной воде.
Синтез оксида углерода
Наиболее целесообразный способ получения СО - обезвоживание концентрированной муравьиной кислоты, что достигается осторожным (по каплям) добавлением конц. H2SO4 к охлаждаемой льдом НСООН, либо холодной НСООН к конц. Н3РО4, нагретой до 80 °С:

Равномерное и непрерывное выделение СО достигается нагреванием смеси конц. Н3РО4 и НСООН (1:1) при 80 °С. Образующийся СО содержит примесь паров воды и кислоты, которые можно удалить промыванием раствором КОН и высушиванием конц. H2SO4.
Синтез диоксида серы
Диоксид серы получают взаимодействием насыщенного водного раствора сульфита натрия Na2SO3 или пиросульфита натрия Na2S2O5 с конц. H2SO4:
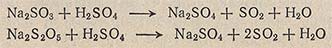
В колбу, снабженную капельной воронкой с капиллярной отводной и газоотводной трубками, помещают насыщенный водный раствор Na2SO3 или Na2S2O5 и прибавляют по каплям конц. H2SO4. Выделяющийся газ пропускают через две промывные склянки с конц. H2SO4 и сжижают в сосуде, охлаждаемом смесью льда и NaCl.
Синтез сероводорода
Сероводород высокой степени чистоты образуется при нагревании концентрированного раствора гидросульфида магния Mg(HS)2:

Гидросульфид магния получается при смешивании конц. растворов MgCl2 и NaHS (мольное соотношение 1:2):

В качестве реакционного сосуда может служить круглодонная колба вместимостью 1 л с резиновой пробкой, имеющей два отверстия, через которые проходят капельная воронка вместимостью 250 мл и газоотводная трубка. Из капельной воронки вначале приливают 250 мл насыщенного раствора MgCl2, затем столько же дистиллированной воды и, наконец, 250 мл насыщенного раствора NaHS. При незначительном нагревании (40-60 °С) реакционной колбы начинается выделение H2S равномерным током. Выход реакции около 80%, считая на NaHS.
Синтез хлора
Хлор высокой степени чистоты получают реакцией между НСl (3 об.ч. конц. НСl и 1 об.ч. дистиллированной воды) и твердым бихроматом калия K2Cr2O7, протекающей при нагревании:
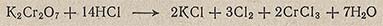
Твердый измельченный K2Cr2O7 помещают в круглодонную колбу, снабженную делительной воронкой и газоотводной трубкой. Колбу устанавливают в нагревательную жидкостную баню (солевую) и при нагревании приливают из капельной воронки НСl. Интенсивность выделения Сl2 регулируют нагреванием бани. Хлор осушают конц. H2SO4 и СаСl2.
Синтез хлористого водорода
Легко регулируемый ток хлористого водорода получают прибавлением чистой конц. соляной кислоты к конц. H2SO4 или наоборот.
Для получения относительно небольших количеств НСl можно использовать толстостенную колбу для фильтрования под вакуумом, снабженную пробкой и воронкой, оттянутый конец которой доходит почти до дна колбы. Склянку наполняют конц. H2SO4, а воронку - соляной кислотой. Из капельной воронки постепенно добавляют соляную кислоту к серной; при этом следует предварительно заполнить оттянутый конец отводной трубки капельной воронки соляной кислотой, чтобы обеспечить гидростатическое давление, необходимое для вытекания кислоты у дна сосуда.

Равномерного выделения НСl можно также достигнуть при приливании конц. H2SO4 к кашице, состоящей из смеси тонкоизмельченного NaCl и конц. НСl.
Относительно большие количества НСl целесообразно получать в приборе, изображенном на рис. 149, а. При закрытом кране 5 в склянку 1 наливают конц. соляную кислоту, а из делительной воронки 3 постепенно приливают конц. H2SO4. Газообразный НСl поднимается в колонку навстречу току H2SO4 и выходит через боковую трубку 4. Отработанную кислоту периодически выпускают из склянки 1 через тубус с краном. Хлористый водород осушают Конц. H2SO4 или СаСl2.
Синтез бромистого водорода
Бромистый водород получают гидролизом бромидов фосфора, образующихся при взаимодействии фосфора и брома, или действием брома на тетралин (тетрагидронафталин). Последний способ более удобен и обеспечивает получение сухого бромистого водорода:
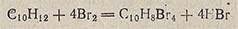
Для этого используют прибор, изображенный на рис. 149,б. В колбу 1, снабженную делительной воронкой 3 и колонкой с кольцами Рашига 2, загружают 200-250 мл тетралина и 3-5 г железных опилок. Тетралин предварительно высушивают над Na2SO4 и перегоняют при атмосферном давлении и 206-208 °С. Реакционную колбу с тетралином помещают на силиконовую баню. К кипящему тетралину из делительной воронки постепенно добавляют бром. Образующийся HBr и пары тетралина поднимаются по колонке 2, где тетралин конденсируется, а бромистый водород выходит из прибора. Колонка 2 соединена с капельной воронкой 3 трубкой, уравнивающей давление, что позволяет осуществить непрерывную подачу брома. Бромистый водород пропускают через промывную склянку с тетралином (для улавливания паров брома) и осушают CaBr2.
