Колориметрические методы анализа
Методы анализа, основанные на сравнении интенсивности окрасок исследуемого раствора и раствора определенной концентрации - стандартного, называются колориметрическими (колориметрией). Различают визуальную колориметрию, осуществляемую при помощи глаза наблюдателя, и фотоэлектрическую колориметрию, осуществляемую при помощи фотоэлемента.
Если пропустить через слой раствора пучок света с интенсивностью I0, то после прохождения через этот слой интенсивность света уменьшится до It. Уравнение основного закона колориметрии - закона Бугера-Ламберта-Беера - имеет следующий вид:
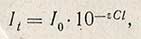
где It - интенсивность светового потока после прохождения через раствор концентрацией С и толщиной слоя l; I0 - интенсивность падающего светового потока; g - коэффициент, зависящий от длины волны падающего света, природы растворенного вещества и температуры раствора; коэффициент g называют молярным коэффициентом погашения. Отношение интенсивности светового потока, прошедшего через раствор It к интенсивности падающего светового потока I0 называется пропусканием, или прозрачностью, и обозначается буквой T:
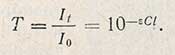
Величина Т, отнесенная к толщине слоя в 1 см, называется коэффициентом пропускания. Логарифм величины, обратной пропусканию, носит название погашения (экстинции) Е, или оптической плотности D:
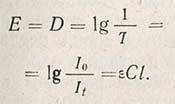
Следовательно, погашение Е прямо пропорционально концентрации вещества в растворе. Если графически изобразить зависимость погашения от концентрации, откладывая по оси абсцисс концентрацию, а по оси ординат - погашение, то получим прямую линию, идущую от начала координат (рис. 52).
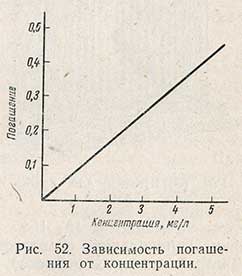
Такой график дает возможность сделать заключение о применимости к исследуемым растворам основного закона колориметрии. Если раствор подчиняется этому закону, то график, выражающий зависимость погашения; от концентрации, будет представлен прямой линией. Если раствор этому закону не подчиняется, то прямолинейность нарушается на каком-то участке кривой или на всей ее длине.
Методы визуальной колориметрии
Визуальная колориметрия осуществляется по одному из следующих методов: 1) метод стандартных серий; 2) метод колориметрического титрования или дублирования; 3) метод уравнивания окраски. Первые два из них не требуют соблюдения основного закона колориметрии; метод уравнивания окрасок требует подчинения растворов основному закону колориметрии.
Метод стандартных серий
Сущность метода. При колориметрировании по методу стандартных серий исследуемый раствор в слое определенной толщины сравнивают с набором стандартных растворов такой же толщины слоя, отличающихся один от другого по интенсивности окраски примерно на 10-15%. Неизвестная концентрация равна концентрации стандартного раствора, окраска которого совпадает с окраской исследуемого раствора или находится между двумя ближайшими более слабо или более сильно окрашенными. Методом стандартных серий можно пользоваться для определения содержания в ректификованном спирте альдегидов, сивушного масла, метилового спирта. Окраску сравнивают в пробирках с притертыми пробками одинакового диаметра из бесцветного стекла одинаковой толщины. Колориметрические пробирки помещают в специальный штатив (рис. 53) и на фоне матового стекла или листа белой бумаги сравнивают окраску исследуемого раствора с окраской типовых растворов. При пользовании пробирками с плоским дном окраски можно сравнивать, рассматривая растворы сверху. Это особенно удобно при работе со слабоокрашенными растзорами.
Содержание сивушного масла в спирте можно определить по реакции с парадиметиламинобензальдегидом. Метод основан на цветной реакции изоамилового, изобутилового и пропилового спиртов с парадиметиламинобензальдегидом. Для проведения определения необходимы следующие реактивы:
1) типовые растворы изоамилового спирта с содержанием его 0,0005; 0,001; 0,002 и 0,003% об. в 96%-ном этиловом спирте, не содержащем сивушного масла и альдегидов;
2) 0,05%-ный раствор парадиметиламинобензальдегида в концентрированной х. ч. серной кислоте относительной плотностью 1,835.
Ход анализа. Отмеряют градуированной пипеткой на 1 мл 0,5 мл исследуемого спирта и помещают в чистую сухую плоскодонную колбу с длинным горлышком, куда прибавляют из измерительного цилиндра 10 мл раствора парадиметиламинобензальдегида. Содержимое перемешивают, колбу погружают в кипящую водяную баню и выдерживают при кипении воды ровно 20 мин. В качестве водяной бани применяют стеклянный химический стакан емкостью 300 мл. Горло колбы при кипячении должно быть в наклонном положении. По истечении 20 мин колбу быстро охлаждают в проточной воде. При этом содержимое колбы приобретает светло-желтоваторозовую окраску, переходящую в розовую различной интенсивности в зависимости от содержания сивушного масла.
Содержимое колбы переливают в пробирку с притертой пробкой. Окраску исследуемого спирта сравнивают с окраской типовых растворов, подвергнутых той же обработке, что и исследуемый спирт. По совпадению окрасок определяют содержание сивушного масла в исследуемом спирте.
Метод колориметрического титрования
В методе колориметрического титрования определенный объем исследуемого окрашенного раствора неизвестной концентрации сравнивают с таким же объемом воды, к которой добавляют окрашенный стандартный раствор определенной концентрации. Добавляют раствор из бюретки (титруют) до уравнивания окраски с исследуемым раствором. В технохимическом контроле бродильных производств этот метод применяют для определения цветности пива, которую выражают в миллилитрах 0,1 н. раствора йода, добавленных к 100 мл дистиллированной воды для уравнивания окраски со 100 мл пива. Ход работы. Определение это проводят следующим образом. Два одинаковых химических стакана емкостью 150-200 мл ставят на лист белой бумаги или на белую фарфоровую пластинку. В один наливают 100 мл пива, в другой - 100 мл дистиллированной воды. В стакан с водой приливают из бюретки при помешивании 0,1 н. раствор йода до тех пор, пока цвет жидкостей не станет одинаковым при рассматривании как сверху, так и сбоку (через жидкость).
Метод уравнивания окраски
Представим себе, что имеются два окрашенных раствора, содержащих одно и то же окрашенное вещество, но в разных концентрациях. Погашение каждого из растворов будет соответственно равно
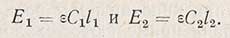
Изменяя толщину слоя этих растворов (l), можно добиться такого состояния, при котором, несмотря на различные концентрации, интенсивность светового потокa, прошедшего через оба раствора, будет одинакова - наступит оптическое равновесие. Это случится тогда, когда оба раствора будут поглощать одну и ту же долю света, т.е. когда погашения растворов будут равны; при этом Е1 = Е2 и eC1l1 = еС2l2. Коэффициент погашения е обоих растворов один и тот же (в растворе содержится одно и то же вещество). Следовательно,
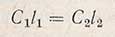
или
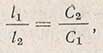
т.е. толщины слоев растворов при одинаковой наблюдаемой окраске обратно пропорциональны концентрациям растворов. Эта зависимость между толщиной слоя и концентрацией лежит в основе метода уравнивания окраски.
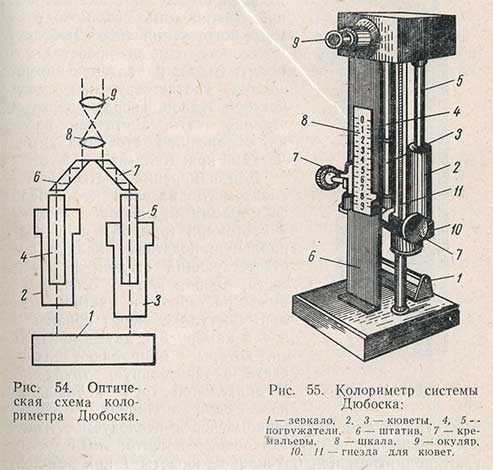
Уравнивание окрасок проводят в специальных приборах - колориметрах. Весьма распространенным является колориметр погружения системы Дюбоска. Оптическая схема этого колориметра такова (рис. 54). Световой поток от зеркала 1 проходит через слой исследуемого раствора в кювете 2, погружатель 4, призму 6, линзы 8 и 9 и попадает в окуляр, освещая правую половину оптического поля. Другой световой поток проходит через слой стандартного раствора в кювете 3, погружатель 5, призму 7, линзы 8 и 9 и попадает в окуляр, освещая левую половину оптического поля. Изменяя с помощью кремальер высоты столбов растворов, добиваются оптического равновесия - исчезновения границы раздела. Общий вид колориметра показан на рис. 55.
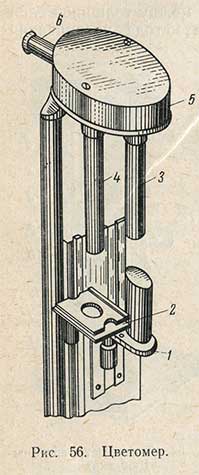
Цветность ликеро-водочных изделий определяют цветомером, представляющим собой колориметр погружения типа Дюбоска у которого одна из кювет заменена рамкой, на которую помещается соответствующий сухой цветной эталон. Твердые цветные эталоны - это ацетатная пленка, окрашенная стойкими химическими красителями.
Для измерения цветности исследуемого изделия его после фильтрации наливают в кювету 1 цветомера (рис. 56), а на специальную подставку кладут соответствующий эталон 2. Лучи света, пройдя кювету с исследуемым раствором и цветной эталон, поступают через призмы 3 и 4 в камеру 5 с двумя призмами, которые направляют лучи света в зрительную трубу 6. В зрительной трубе наблюдают поле, одна половина которого освещена лучом, проходящим через исследуемое изделие. Равномерной окраски обоих сегментов поля достигают поднятием или опусканием кюветы 1 при помощи кремальеры.
После уравнивания окраски в обоих сегментах поля зрения по шкале прибора отсчитывают высоту столба жидкости в миллиметрах и сравнивают ее с высотой столба, утвержденной для заданного изделия. Так, для апельсинового ликера применяют эталон №7, высота столба по шкале цветомера должна составлять 33 мм, для шоколадного ликера - эталон №14, высота столба 26 мм. Указанные данные для всех ликеро-наливочных изделий приведены в инструкции по технохимическому контролю ликеро-водочного производства. Если полученные цифры равны или разнятся между собой на ±5, то считают, что цвет исследуемого изделия соответствует утвержденному образцу. Если полученная высота больше утвержденной, изделие недокрашено, если меньше, то перекрашено.
В наборе эталонов имеются бесцветные светофильтры-компенсаторы, которые служат для уравнения натуральной яркости цветов некоторых изделий с яркостью окраски цветного светофильтра. Компенсатор накладывают на световое отверстие цветомера под кювету с изделием.
Фотоколориметрический метод
Данный метод описан в главе "Фотоэлектрическая колориметрия" книги "Технохимический контроль овощесушильного и пищеконцентратного производства".
Колориметрическое определение содержания углеводов в полупродуктах спиртового производства (метод ВНИИСЛа)
Реактивом для определения содержания углеводов колориметрическим методом в полупродуктах спиртового производства является раствор антрона в х. ч. серной кислоте относительной плотностью 1,830 (концентрацией 0,2% мас.). В сильно кислой среде глюкоза разлагается с образованием фурфурольных производных, которые реагируют с антроном, образуя комплексное соединение зеленого цвета. Указанным методом определяют суммарное количество углеводов, и данные получают в единицах глюкозы. Проводить предварительный гидролиз полисахаридов в глюкозу не требуется, так как реакция с антроном протекает в сильно кислой среде; при этом полисахариды гидролизуются до моносахаридов, которые и реагируют с антроном.
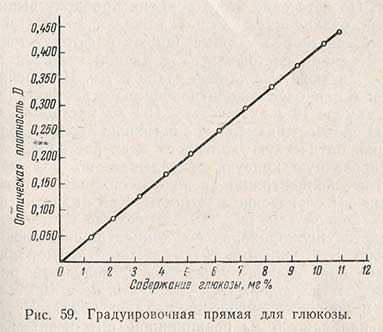
Для определения содержания углеводов необходимо построить градуировочную кривую на растворах х. ч. глюкозы концентрацией 5-10 мг/100 мл (рис. 59). Градуировочную кривую строят следующим образом. Готовят растворы х. ч. глюкозы концентрацией от 5 до 10 мг в 100 мл раствора через каждый миллиграмм. Затем в пробирку из тугоплавкого стекла емкостью 20 мл наливают 5 мл реактива и осторожно добавляют туда 2,5 мл приготовленного раствора глюкозы так, чтобы образовалось два слоя. Пробирку закрывают притертой пробкой, содержимое ее быстро перемешивают и помещают пробирку в кипящую водяную баню на 6 мин. По истечении этого времени пробирку вынимают из бани, реакционную смесь охлаждают до 20° С и окрашенный раствор колориметрируют в фотоколориметре с применением светофильтра с длиной световой волны 610 нм и кюветы с длиной грани 5 мм. Измерения начинают с наиболее концентрированного раствора (в данном примере 10 мг глюкозы в 100 мл раствора). Оптическую плотность измеряют с помощью левого барабана. Измерив оптическую плотность всех растворов, строят градуировочную кривую, откладывая по оси абсцисс известные концентрации, а по оси ординат - соответствующие им оптические плотности. Как видно из приведенной кривой (см. рис. 59), оптическая плотность увеличивается пропорционально концентрации глюкозы в растворе. Эта зависимость выражается прямой линией.
Для определения углеводов исследуемый раствор разбавляют до содержания их 5-10 мг в 100 мл раствора и проводят определение таким образом: в пробирку наливают 5 мл реакционной смеси, затем осторожно добавляют 2,5 мл исследуемого раствора так, чтобы образовались два слоя. В дальнейшем поступают, как и при построении градуировочной кривой. Определив оптическую плотность D по градуировочной прямой находят содержание глюкозы в растворе. Содержание глюкозы в растворе можно также подсчитать по уравнению
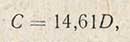
которое является уравнением градуировочной прямой и составлено по координатам этой прямой.
Обычно оптическую плотность определяют в кювете с длиной грани 5 мм. Если же раствор глюкозы будет очень концентрированным, то после реакции с антроном получится слишком интенсивно окрашенный раствор, оптическая плотность которого будет больше предельной оптической плотности барабана фотоколориметра и нельзя будет определить ее значение; при сильно разбавленном растворе глюкозы значение оптической плотности будет мало и ошибка определения значительна. В обоих случаях следует повторить анализ, изменив соответствующим образом разведение раствора. Можно также, не повторяя анализа, определить оптическую плотность, применив при колориметрировании другую кювету: для сильно окрашенных растворов с длиной грани 3 или 1 мм, для слабоокрашенных - 10 или 20 мм. Получив оптическую плотность в других кюветах, нельнельзя определять содержание глюкозы по градуировочной прямой, составленной применительно к кювете с длиной грани 5 мм. Необходимо предварительно подсчитать величину оптической плотности раствора, которая получается при этой длине грани кюветы по уравнению

где D5 - оптическая плотность раствора, полученная с применением кюветы с длиной грани 5 мм; Dx - оптическая плотность раствора, полученная в кювете с длиной грани а мм.
Указанный метод применим для растворов, содержащих глюкозные остатки, в которых отсутствуют пентозы и пентозаны.
Определение содержания растворимых несброженных углеводов в зерно-картофельной зрелой бражке (метод ВНИИСЛа)
В зерно-картофельной зрелой бражке наряду с углеводами, которые могут быть превращены в спирт (крахмалом, декстринами, мальтозой, глюкозой), содержатся также пентозы и пентозаны, которые в спирт не превращаются. При определении химическим методом находят общее количество углеводов. Между тем очень важно знать содержание в бражке сбраживаемых углеводов, которые могли сбродить, но не сбродили из-за неполного осахаривания и брожения, - так называемых несброженных углеводов. До последнего времени их определяли по разности между общим количеством углеводов и пентоз; определение пентоз (см. стр. 82) сравнительно сложно и длительно. Колориметрический анализ дает возможность провести прямое определение несброженных углеводов в бражке.
Известно, что антрон дает окрашивание со всеми углеводами, в том числе и с пентозами. Однако антроновая реакция примерно в 12 раз менее чувствительна при определении пентоз, чем при анализе гексоз. ВНИИСЛ разработал новую модификацию антронового метода, в которой устранено влияние пентоз и пентозанов на результаты анализа. Эта модификация основана на следующем законе колориметрии: оптическая плотность смеси компонентов равна сумме произведений коэффициентов погашения отдельных компонентов на их концентрацию
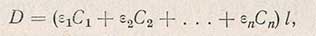
где D - оптическая плотность смеси, равная lg0/l. Здесь l0 - интенсивность исходного света; l - интенсивность света, прошедшего через раствор; e1, e2, ..., en - коэффициенты погашения;
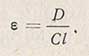
Здесь D - оптическая плотность компонента, С - концентрация компонента в растворе, l - длина грани кюветы.
Оптическая плотность раствора зависит от длины волны. При разработке метода были подобраны две волны. При одной из них первый компонент (глюкоза) имеет интенсивную полосу, а второй (арабиноза) поглощает лишь очень слабо. При другой длине волны должна быть обратная картина. На основании проведенных исследований были выбраны для колориметрирования светофильтры с длиной световой волны 610 и 413 нм.
Определение содержания несброженных углеводов в бражке проводят следующим образом. Взвешивают навеску 25 г фильтрата бражки в стаканчике, переносят ее в мерную колбу емкостью 200 мл. Стаканчик ополаскивают водой и промывные воды сливают в ту же колбу. Затем в колбу добавляют для осветления 2 мл 30%-ного раствора сернокислого цинка, перемешивают, выдерживают 2-3 мин и добавляют 2 мл 15%-ного раствора желтой кровяной соли и снова перемешивают. Объем раствора доводят дистиллированной водой до метки.
Раствор фильтруют в сухую колбу. Первые 20-30 мл фильтрата выливают, а последующие порции используют для анализа. Фильтрат вторично разбавляют с таким расчетом, чтобы в 100 мл раствора содержалось углеводов от 5 до 12 мг. Для определения в пробирку емкостью 20 мл с притертой пробкой наливают 10 мл антронового реактива и осторожно добавляют 5 мл исследуемого раствора таким образом, чтобы жидкости не смешивались, а получилось два слоя; пробирку закрывают притертой пробкой. Параллельно готовят холостой раствор, добавляя к 10 мл реактива 5 мл дистиллированной воды. Содержимое пробирок энергично перемешивают в течение 10 сек и погружают в бурно кипящую водяную баню. Кипение должно возобновиться в течение 0,5 мин с момента погружения пробирок в баню. Замечают начало кипения воды в бане и выдерживают 5,5 мин для проведения реакции. После выдерживания пробирки охлаждают в бане с проточной водой до 20° С. Определяют оптическую плотность полученного раствора на левом барабане фотоэлекгроколориметра с применением двух светофильтров: оранжевого с длиной волны Л=610 нм и синефиолетового с Л=413 нм в кювете с длиной грани 5 мм. Кювету ополаскивают 2-3 раза исследуемым раствором, затем заполняют ее так, чтобы жидкость не доходила до краев на 5 мм. Внешние стенки кюветы обмывают струей воды и вытирают сухой фильтровальной бумагой. Таким же образом наливают холостой раствор в две другие кюветы такого же размена и проводят определение оптической плотности.
По значениям оптической плотности находят содержание растворимых несброженных углеводов по уравнениям:
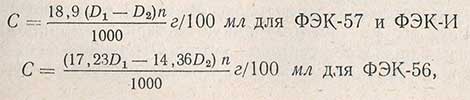
Где D1 - оптическая плотность при светофильтре с длиной волны Л = 610 нм; D2 - оптическая плотность при светофильтре с длиной волны Л = 413 нм; n - коэффициент разведения.
