Электрогравиметрический анализ
Электрогравиметрические определения катионов основаны на электролитическом осаждении из растворов металлов на взвешенном электроде, главным образом на катоде, на аноде осаждается только свинец или марганец, окисляясь в процессе электролиза до PbO2 или MnO2. О количестве выделенного металла судят по увеличению массы катода.
Материалом катода чаще всего служит платина. Она лучше других металлов и сплавов удовлетворяет требованиям гравиметрического анализа и условиям проведения электролиза. Платина не растворяется под действием тока и под влиянием веществ, находящихся в растворе, в том числе и кислот. Образующийся в результате электролиза осадок плотно оседает на электроде, а затем легко снимается с него растворением. Электрод не изменяется при хранении на воздухе.
Установка для электрогравиметрического анализа
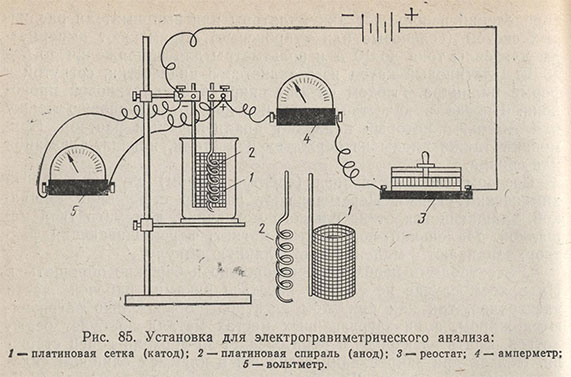
В качестве источников постоянного тока для электрогравиметрических определений используют аккумуляторы или выпрямители различных систем (селеновые или купроксные). Применяют амперметры для силы тока до 10 А и вольтметры для напряжения до 5-10 В. Платиновый катод изготовляется в виде сетки, согнутой в форме цилиндра. Анодом служит спираль из платиновой проволоки. Иногда в качестве анода используют платиновую чашку или тигель, в который наливают анализируемый раствор. Применяют также аноды из нержавеющей стали, никеля, алюминия или свинца.
Сосудом для электролиза (электролизером) служит обычный химический стакан. Перемешивают раствор стеклянной мешалкой, вращающейся от небольшого моторчика, или магнитной мешалкой. Маленький постоянный магнит, перемешивающий раствор, запаивают в маленькую стеклянную ампулу.
С электродами необходимо осторожно и бережно обращаться. Ни в коем случае не следует касаться руками рабочей части электродов, так как при этом электроды обязательно загрязняются жиром, а на загрязненных местах металл не будет осаждаться. Брать электроды в руки следует за верхний конец стержня. Нельзя при закреплении стержней в клеммах слишком сильно завинчивать винты. Для очистки электроды погружают на некоторое время (5-10 мин) в горячую HNO3 (1:1). Вынув электроды из раствора, дают стечь каплям HNO3, промывают электрод водопроводной, затем дистиллированной водой. Раствором HNO3 для промывания электродов можно пользоваться много раз.
Жировые загрязнения можно легко снять с электрода, нагревая его в пламени горелки до красного каления. На электроде не должно быть остатков постороннего металла, так как при прокаливании может образоваться сплав металла с платиной.
После промывки анод можно считать подготовленным. Катод же перед взвешиванием необходимо высушить. Для этого катод погружают в этанол (для удаления воды), а затем (для удаления этанола) - диэтиловый эфир (вдали от огня!). Для удаления эфира (Ткип = 35°С) достаточно подержать электрод высоко над плиткой несколько минут. Через 3-5 мин электрод взвешивают. Электрод можно промывать и одним этанолом, но в этом случае высушивание проводят в сушильном шкафу при 110 °С в течение 5 мин. Этанол и диэтиловый эфир для промывания электродов можно использовать много раз.
Для электролиза собирают установку, как показано на рис. 85. К зажимам анода и катода подключают соответствующие провода от аккумулятора («+» к аноду, «-» к катоду). В цепь последовательно включают реостат на 20-30 Ом и амперметр на 5 А, параллельно включают вольтметр на 5-10 В. Если в качестве источника тока используют ток осветительной сети, необходимо в цепь включить выпрямитель тока и понижающий трансформатор (ЛАТР).
Порядок работы
Раствор для электролиза готовят по аналитической методике. Стакан с раствором помещают в штатив и погружают в него электроды. Сетчатый катод закрепляют так, чтобы он не касался ни дна, ни стенок стакана и находился на одинаковом расстоянии от них. Анод закрепляют в центре сетчатого катода.
Раствор в стакане разбавляют водой до такого объема, чтобы уровень его примерно на 1 см не доходил до верхнего края стакана. После этого включают ток и мешалку. Нужное напряжение устанавливают с помощью реостата. Иногда раствор предварительно нагревают до 50-70 °С, что ускоряет электролиз.
Электролиз продолжают до полного выделения катиона, что определяют по обесцвечиванию раствора или капельной качественной реакцией на осаждаемый катион. При осаждении меди в раствор добавляют воду, чтобы уровень жидкости поднялся на 2-3 мм. Если на вновь погруженной части сетчатого катода не появляется цветного налета меди, это означает, что электролиз закончен.
Не выключая тока, вынимают электроды из стакана, поднимают их кверху. Стакан с раствором убирают, электроды промывают из промывалки водой над другим стаканом. Выключают ток и вынимают электроды из клемм. Катод помещают на листок фильтровальной бумаги, дают стечь с катода воде, затем его промывают этанолом и эфиром и после высушивания взвешивают.
По окончании определения катод очищают от слоя металла, погружая его в горячий раствор HNO3 (1:1) до полного растворения осадка. Затем катод промывают водопроводной и дистиллированной водой. Некоторые элементы определяют на катоде, покрытом другим металлом, например серебром, медью или ртутью.
Для покрытия платинового катода серебром растворяют 0,2 г AgNO3 в 200 мл воды, добавляют 1 н. раствор NaOH до полного осаждения серебра, затем осадок растворяют добавкой 10%-ного раствора KCN. Погружают электроды в раствор и включают ток 0,1 А на 10 мин для осаждения серебра, затем промывают, сушат и перед употреблением взвешивают.
Для покрытия катода медью растворяют 0,2 г CuSO4-5H2O в 200 мл воды, добавляют 5 мл концентрированной H2SO4 и 3 мл свежепрокипяченной концентрированной HNO3. Погружают электроды в раствор и включают ток 0,1 А на 10 мин для осаждения меди, затем электроды промывают, сушат и взвешивают перед применением.
Для покрытия катода ртутью растворяют 0,8 г Hg2(NO3)2-2H2O в 10 мл концентрированной HNO3 и разбавляют водой до 100 мл. Электроды погружают в раствор и осаждают ртуть при силе тока 0,1 А в течение 45 мин. После электролиза электроды промывают, сушат и взвешивают перед применением.
Разделение ионов на ртутном катоде
Для разделения элементов применяют электролиз на ртутном катоде, в результате которого Fe, Cr, Mn и другие элементы осаждаются на ртутном катоде, образуя амальгамы, а Al, Ti и V остаются в растворе.
Электролиз проводят в приборе, представленном на рис. 86. На дно сосуда помещают 200-300 г ртути, наливают в сосуд раствор, подлежащий электролизу, объемом около 100 мл и опускают в раствор платиновый электрод. Ртуть соединяют платиновой проволочкой с отрицательным полюсом, платиновый анод - с положительным полюсом источника тока силой 3-6 А и напряжением 6-8 В. Электролиз ведут 20-25 мин.
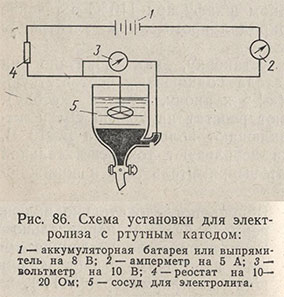
Окончание электролиза определяют соответствующей капельной качественной реакцией на удаляемый ион. Убедившись в полноте выделения, не выключая тока, сливают через кран почти всю ртуть в предназначенный для этого сосуд. Раствор переливают сифоном или через второй кран в большой стакан. Не прерывая тока, промывают сосуд для электролиза 2-3 раза водой и промывные воды также добавляют к анализируемому раствору, затем отключают ток. Общий объем раствора доводят до 250-300 мл и в нем определяют Al, Ti или V.
