Метод нейтрализации
Для выполнения определений по методу нейтрализации применяют титрованные растворы кислот (серной, соляной или азотной) и растворы щелочей (гидроксидов натрия, калия или бария). Для установления точки эквивалентности применяют индикаторы, изменяющие окраску в определенной области pH.
Индикаторы метода нейтрализации
Метиловый оранжевый. Область перехода окраски при pH 3,1-4,4. Для титрования берут 1-2 капли раствора на 20-25 мл титруемого раствора. Для приготовления раствора индикатора растворяют 2 г сухого метилового оранжевого (метилоранжа) в 1 л воды. Переход окраски от красной к желтой.
Метиловый красный. Область перехода окраски при pH 4,2-6,2. Дает более резкий переход окраски, чем метиловый оранжевый. Для титрования применяют не более одной капли 0,2%-ного этанольного раствора на 25 мл титруемого раствора, при больших количествах индикатора переход окраски труднее заметен. Переход окраски от красной к желтой.
Фенолфталеин. Область перехода окраски при pH 8,2-10,0. Для титрования используют 1-2 капли 1%-ного этанольного (70%-ного) раствора индикатора на 25 мл титруемого раствора. Переход окраски от красного к бесцветному. Красная (розовая) окраска легко обесцвечивается под действием CO2, выделяющегося в результате реакции. Оттитрованные до розовой окраски растворы при стоянии могут также обесцветиться под действием CO2 воздуха. Применяют при титровании слабых кислот. Имеются и другие индикаторы.
Приготовление рабочих растворов и установка их титров
Приготовление 0,1 н. раствора серной кислоты. Эквивалент серной кислоты ЭH2SO4 = 98,08 : 2 = 49,04 г. Для приготовления 0,1 н. раствора необходимо получить раствор, содержащий в 1 л 49,04 * 0,1 = 4,90 г H2SO4. Раствор готовят приближенной концентрации из разбавленной 1:2 или 1:5 серной кислоты; далее точную нормальность раствора устанавливают титрованием. Для приготовления 1 л 0,1 н. раствора H2SO4 необходимо 16,8 мл кислоты плотностью 1,18 г/см3 (разбавленной 1:5) или 8,1 мл кислоты плотностью 1,35 г/см3 (разбавленной 1:2) разбавить водой в мерной колбе вместимостью 1 л до метки.
Для вычисления объема исходной серной кислоты, необходимой для приготовления 1 л 0,1 н. раствора H2SO4, нужно 0,1 эквивалента H2SO4 (4,9 г) умножить на 100 и разделить на процентное содержание H2SO4 в кислоте. Получают навеску кислоты в граммах; разделив ее на плотность, получают объем в миллилитрах.
Установка титра и нормальности 0,1 н. раствора серной кислоты. По тетраборату натрия Na2B4O7-10H2O. Тетраборат натрия гидролизуется в водном растворе с образованием ионов OH-:
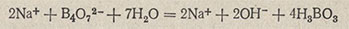
которые и титруются кислотой. Поскольку ионы гидроксила связываются ионами водорода, реакция протекает до конца. Суммарно реакцию можно представить следующим уравнением:
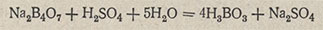
Эквивалент тетрабората натрия в этой реакции равен 1/2 моля, а его масса равна Э = 381,37 / 2 = 190,69 г/моль. Чтобы препарат тетрабората натрия соответствовал формуле Na2B4O7-10H2O, его перекристаллизовывают. Для этого растворяют 140-150 г тетрабората натрия в 300 мл воды при нагревании не выше 60 °С. Раствор фильтруют через складчатый фильтр в фарфоровую чашку, охлаждаемую льдом. Фильтрат помешивают стеклянной палочкой, выделившиеся кристаллы отфильтровывают с отсасыванием, промывают небольшим количеством холодной воды и повторяют перекристаллизацию. Полученные кристаллы высушивают на воздухе 2-3 дня. Продаваемые препараты не соответствуют своей формуле из-за выветривания.
Для установки титра кислоты нужно взять такую навеску тетрабората натрия, чтобы на нее было израсходовано примерно 25 мл раствора кислоты. Навеска будет составлять: 191 * 0,1 * 25 : 1000 = 0,5 г.
Для установки титра кислоты берут 3-4 конические колбы вместимостью 100-150 мл и помещают в каждую точную навеску (около 0,5 г) тетрабората натрия. Каждую навеску растворяют примерно в 50 мл воды при слабом нагревании. Добавляют сначала в раствор одной из навесок 2-3 капли раствора индикатора метилового красного или метилового оранжевого. Раствор приобретает желтую окраску. Титруют приготовленным раствором (примерно 0,1 н.) кислоты до появления розового (с метиловым красным) или оранжевого (с метиловым оранжевым) окрашивания. Титрование ведут, сначала прибавляя раствор кислоты из бюретки малыми порциями при непрерывном перемешивании, затем осторожно титруют быстро падающими каплями, под конец титрование замедляют, последние капли добавляют по одной после сильного взбалтывания. Меньшую навеску следует титровать первой, потому что это даст приблизительную ориентировку в расходовании раствора на последующие навески. Такой способ установки титра называется методом отдельных навесок.
Для установки титра методом пипетирования готовят точно 0,1 н. раствор тетрабората натрия. Для этого точную навеску (19,07 г на 1 л или 4,760 г на 250 мл) тетрабората натрия взвешивают на часовом стекле и переводят в мерную колбу через воронку. Воронку и часовое стекло обмывают из промывалки струей горячей воды, затем колбу наполняют водой на 2/3 объема. Взбалтывая содержимое колбы круговыми движениями, растворяют навеску, после чего охлаждают до комнатной температуры, разбавляют водой до метки и перемешивают.
Отбирают пипеткой 25,0 мл приготовленного раствора тетрабората натрия в колбу для титрования, добавляют 2-3 капли раствора индикатора (метилового оранжевого или метилового красного) и титруют раствором кислоты, как и в случае отдельных навесок. Рекомендуется титровать со «свидетелем». Для приготовления «свидетеля» в колбу для титрования наливают мензуркой 50 мл воды, две капли раствора индикатора и одну каплю кислоты из бюретки, чтобы появилось очень слабое, но вполне заметное оранжевое или розовое окрашивание. Титрование тетрабората проводят до появления такой же интенсивности окраски, как у «свидетеля».
Для вычисления нормальности раствора кислоты по методу отдельных навесок пользуются формулой
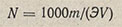
где N - определяемая нормальность кислоты; m - навеска тетрабората, г; Э - эквивалентная масса тетрабората, г/моль; V - объем раствора кислоты, затраченный на титрование навески, мл.
По каждой навеске вычисляют нормальность и находят ее среднее значение. При титровании методом пипетирования расчет ведут по формуле
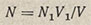
где N - искомая нормальность раствора кислоты; N1 - нормальность раствора тетрабората натрия; V1 - объем раствора тетрабората натрия, мл; V - объем, раствора кислоты, мл.
Например, навеска тетрабората натрия 4,8024 г растворена в мерной колбе вместимостью 250 мл и разбавлена водой до метки. На 25,0 мл этого раствора было израсходовано (среднее из четырех титрований) 25,85 мл устанавливаемого раствора H2SO4. Нормальность приготовленного раствора тетрабората натрия находят по формуле
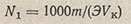
где m - навеска тетрабората, г; Э - эквивалентная масса тетрабората, г/моль; Vк - объем колбы с раствором тетрабората натрия, мл. Подставив в эту формулу приведенные значения, получим:
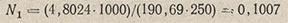
Нормальность раствора серной кислоты:

Титр раствора серной (или другой) кислоты можно устанавливать также то карбонату натрия или по стандартному раствору гидроксида.
Приготовление 0,1 н. раствора гидроксида натрия (едкого натра). Для приготовления нужно пользоваться химически чистым реактивом (хч). Навеску берут несколько большей, чем требуется по расчету (на 30-50%). Взвешивают на химических лабораторных весах, отбирая шпателем свежие куски. Навеску помещают в фарфоровый стакан и дважды быстро промывают ее водой для удаления карбоната. Обмытые куски щелочи растворяют в небольшом количестве воды, переливают в склянку, предназначенную для хранения раствора щелочи, и разбавляют до необходимого объема прокипяченной (для удаления CO2) и затем охлажденной дистиллированной водой.
Растворы едкого натра (как и других щелочей) сильно поглощают CO2 из воздуха и изменяют свой титр. Поэтому растворы щелочей хранят в герметически закрытых склянках, защищая их от действия CO2 воздуха пробкой с хлоркальциевой трубкой, заполненной натронной известью; бюретку присоединяют к бутыли с помощью сифона.
Установление титра и нормальности 0,1 н. раствора гидроксида натрия. По щавелевой кислоте H2C2O4-2H2O. Щавелевая кислота взаимодействует со щелочью по уравнению
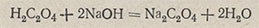
Эквивалент щавелевой кислоты равен 1/2 моля, а его масса
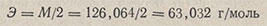
Для установления нормальности методом отдельных навесок растворяют 0,25 г (точную навеску) свежеперекристаллизованной щавелевой кислоты в 25 мл воды, добавляют 1-2 капли раствора фенолфталеина и титруют раствором NaOH до появления устойчивого розового (малинового) окрашивания. Нормальность вычисляют по формуле, приведенной выше. Нормальность можно установить методом пипетирования.
Для титрования можно применять только свежеприготовленный 0,1 н. раствор щавелевой кислоты. Раствор щавелевой кислоты неустойчив при хранении, поэтому для разового пользования его готовят не более 250 мл.
По янтарной кислоте HOOC-CH2-CH2-COOH. Янтарная кислота не содержит кристаллизационной воды, не гигроскопична. Продажные препараты квалификации хч или чда содержат не менее 99,9% основного вещества. Эквивалент янтарной кислоты равен 1/2 моля, а его масса 59,04 г/моль.
Для определения нормальности раствора NaOH растворяют 0,20-0,25 г янтарной кислоты (точное взвешивание) в 25 мл воды, добавляют 2-3 капли раствора фенолфталеина и титруют раствором NaOH до появления розового окрашивания, не исчезающего в течение 1 мин. Для устранения влияния CO2 раствор кипятят и титруют горячим. Титр устанавливают по отдельным навескам, так как янтарная кислота неустойчива при хранении в растворе. Нормальность можно устанавливать также по стандартному раствору кислоты с известным титром.
