Глава V. Химические методы технического анализа сырья, полупродуктов и лекарственных препаратов
Химические методы анализа, т. е. методы, основанные на проведении химических реакций, являются основными в техническом анализе.
Объемные (титриметрические) методы технического анализа
К объемным, или титриметрическим, методам относят методы количественного анализа, основанные на измерении количества реагента, требующегося для завершения реакции с данным количеством определяемого вещества. Основные достоинства объемных методов анализа заключаются в том, что для количественного определения содержания вещества требуется малое его количество, а само определение проводится за несколько минут.
Основные сведения об объемных методах анализа достаточно подробно рассматриваются в курсе аналитической химии. Поэтому мы остановимся лишь на специфических для анализа химико-фармацевтических препаратов особенностях титриметрических методов.
Напомним, что точность титриметрического анализа определяется правильностью определения точки эквивалентности, т. е. того момента, когда в процессе титрования количество стандартного раствора титранта становится теоретически строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции. Теоретически в точке эквивалентности не должно быть ни титранта, ни определяемого вещества, так как используемые для объемно-аналитических определений реакции, как правило, необратимы и протекают до конца. Однако в ряде случаев истинная точка эквивалентности не регистрируется из-за того, что аналитическая реакция в той или иной мере обратима, а также потому, что конечная точка титрования (т. е. момент изменения цвета индикатора) не совпадает абсолютно с точкой эквивалентности. Поэтому вводят поправочные коэффициенты, которые вычисляют на основании данных, полученных при титровании в тех же условиях растворов с точно известным содержанием определяемого вещества.
В большинстве случаев титрование ведут в присутствии специально добавляемого вспомогательного вещества - индикатора, который резко меняет окраску вблизи точки эквивалентности под влиянием малейшего избытка титранта. В последнее время точку эквивалентности все чаще фиксируют физико-химическими (инструментальными) методами (см. главу VI). Таким образом, при титриметрических определениях очень важно правильно выбрать методику проведения анализа, индикатор конца реакции, стандартные вещества для точного установления титров используемых растворов.
Объемные методы анализа основаны на использовании различных химических реакций. Важнейшими из них являются реакции нейтрализации, окислительно-восстановительные реакции, а также реакции осаждения, комплексообразования, замещения, присоединения, конденсации.
К реакциям, применяемым в объемном анализе, предъявляется ряд определенных требований:
а) вещества, вступающие во взаимодействие, должны реагировать в строго определенных количественных соотношениях (стехиометрических);
б) реакции между титрантом и определяемым веществом должны протекать быстро и практически до конца;
в) примеси в исследуемом продукте, а также растворитель не должны мешать определению;
г) точка эквивалентности должна фиксироваться резко и точно;
д) реакции должны протекать при комнатной температуре и атмосферном давлении или в условиях, легко воспроизводимых в лаборатории;
е) титрование не должно сопровождаться побочными реакциями, искажающими результат анализа.
Основные правила, соблюдение которых необходимо для получения надежных результатов, сводятся к следующему:
а) рабочее место должно быть тщательно подготовлено и хорошо освещено;
б) посуда и измерительные приборы должны быть тщательно вымыты и точно откалиброваны;
в) все используемые в анализе вещества должны полностью удовлетворять предъявляемым к ним требованиям и не содержать примесей, искажающих результаты анализа;
г) в тех случаях, когда содержащийся в воздухе кислород или углекислый газ могут влиять на результаты титрования, оно должно проводиться в атмосфере инертного газа (например, азота);
д) титрование всегда проводят при перемешивании реакционной массы;
е) титрование должно завершаться в короткий промежуток времени (обычно до 10 мин) и проводиться в строго контролируемых условиях;
ж) рекомендуемая методика проведения анализа должна выполняться одинаково во всех опытах, отступления от методики недопустимы;
з) титры применяемых стандартных растворов перед титрованием должны быть установлены или проверены по химически чистым или чистым для анализа стандартным веществам;
и) все параллельные определения должны быть закончены в один день.
Основные методы титрования могут быть разделены на несколько групп.
Простейший прием титриметрического анализа - прямое титрование. Он состоит в том, что к определенному объему раствора анализируемого вещества добавляют из точно калиброванной бюретки стандартный раствор реагента с известным титром до достижения точки эквивалентности. Зная титр раствора и объем его, пошедший на титрование, легко по уравнению реакции рассчитать количество анализируемого вещества, содержащееся в исследуемой пробе, объем которой также известен.
Примерами прямого титрования могут служить определения концентраций кислот и щелочей.
В некоторых случаях используют метод обратного титрования (титрование по остатку). Для этого к определенному объему раствора или навеске исследуемого вещества добавляют точно измеренный объем раствора реагента с известным титром, взятый в избытке. Избыток не вступившего в реакцию реагента оттитровывают вспомогательным титрантом точно известной концентрации. Зная общее количество основного реагента и количество его, не вошедшее в реакцию, легко рассчитать содержание исследуемого вещества в пробе.
Несколько иной метод - косвенное титрование. Сущность одного из вариантов косвенного титрования заключается в том, что к определяемому веществу прибавляют вспомогательный реагент. Это приводит к образованию эквивалентного количества нового вещества, которое и оттитровывается затем стандартным раствором основного реагента. Пояснить это можно на следующем примере. Окислитель KMnO4 можно было бы титровать стандартным раствором восстановителя. Однако такой стандартный восстановитель, как Na2S2O3, нельзя по ряду причин применять для титрования сильных окислителей. Поэтому предварительно действуют на KMnO4 в кислой среде вспомогательным реагентом KI, который реагирует с KMnO4 с выделением свободного йода, причем последний выделяется в эквивалентном по отношению к KMnO4 количестве. Выделившийся йод можно оттитровать раствором основного реагента - Na2S2O3. Конец титрования определяют по крахмалу, соединение которого с йодом имеет сине-фиолетовую окраску. При титровании тиосульфатом в точке эквивалентности окраска исчезает. Количество израсходованного Na2S2O3 эквивалентно количеству выделившегося йода, а количество йода в свою очередь эквивалентно количеству KMnO4. Таким образом, зная пошедшее на титрование количество стандартного раствора Na2S2O3, легко рассчитать количество KMnO4 в исследуемой пробе.
В практике технического анализа часто применяют метод реверсивного титрования (не путать с обратным титрованием!). Реверсивным титрованием определяют, в частности, содержание нитритов и азотистой кислоты по реакции с перманганатом калия в кислой среде. Поскольку нитриты и азотистая кислота в кислом растворе неустойчивы, то титруют кислый раствор перманганата калия (титр и объем которого известны) анализируемым раствором нитрита. Такой способ титрования дает возможность предотвратить разложение азотистой кислоты и обеспечивает более точный результат, чем прямое титрование.
Приводим краткое описание рекомендуемых при анализе лекарственных веществ и полупродуктов для них способов установления титров стандартных растворов (титрантов).
Концентрацию соляной и серной кислот устанавливают титрованием водного раствора, приготовленного из точной навески около 1,5 г безводного карбоната натрия, предварительно высушенного при 270 С в течение часа. Раствор ~1,5 г карбоната в 50 мл воды титруют исследуемым раствором соляной кислоты (реверсивное титрование) ~ 1 н. концентрации; индикатор - метиловый оранжевый.
Концентрацию уксусной кислоты устанавливают титрованием точно отмеренного ее количества стандартным раствором едкого натра; индикатор - фенолфталеин.
Нормальность раствора щавелевой кислоты устанавливают прямым титрованием свежестандартизованным раствором перманганата калия.
Установка титра растворов едкого натра и едкого кали проводится по двум индикаторам - фенолфталеину и метиловому оранжевому. По фенолфталеину титруют до розового окрашивания точную навеску химически чистой янтарной кислоты (реверсивное титрование), а по метиловому оранжевому до розовато-оранжевого окрашивания титруют точно отмеренный объем исследуемого щелочного раствора стандартным раствором соляной кислоты (прямое титрование). Растворы щелочей должны быть защищены от воздействия углекислоты воздуха. Титр растворов следует часто проверять.
Концентрацию растворов аммиака рекомендуют устанавливать потенциометрическим титрованием 0,01 н. раствором серной кислоты до pH 6,0. При отсутствии pH-метра можно титровать раствором серной кислоты по индикатору метиловому оранжевому до перехода желтой окраски в розовую.
Точную концентрацию растворов брома устанавливают, прибавляя к точно отмеренному количеству анализируемого раствора раствор йодида калия и соляной кислоты и титруя стандартным раствором тиосульфата натрия (косвенное титрование).
Концентрацию растворов йода устанавливают титрованием раствором тиосульфата натрия, используя в качестве индикатора крахмал. Титр раствора следует часто проверять.
Растворы бромата калия можно анализировать, добавляя к ним йодид и соляную кислоту и оттитровывая выделившийся йод тиосульфатом. Аналогично, но в среде разбавленной серной кислоты определяют концентрацию йодата калия.
Концентрацию перманганата калия устанавливают либо косвенным титрованием (см. с. 67), либо титрованием точной навески химически чистого оксалата натрия (Na2C2O4). Титрование ведут при 60-70 С до появления светло-розового окрашивания, устойчивого в течение 15 с.
Раствор сульфита натрия анализируют следующим образом. Помещают в колбу с притертой пробкой точно отмеренное количество раствора йода известной концентрации, точно отмеренное количество анализируемого раствора сульфита натрия и разбавленную соляную кислоту. Титруют раствором нитрита натрия; индикатор - крахмал.
Концентрацию раствора тиосульфата натрия определяют следующим способом. В склянке с притертой пробкой смешивают точно отмеренное количество раствора бихромата калия известной концентрации, точную навеску йодида калия и соляную кислоту. После 10-минутной выдержки оттитровывают выделившийся йод анализируемым раствором тиосульфата; индикатор - крахмал.
Приведенные примеры иллюстрируют общие положения, изложенные в начале главы, и показывают многообразие приемов титрования, используемых в техническом анализе. Однако этих методов оказывается недостаточно при техническом анализе промежуточных продуктов и лекарственных веществ. Последние часто бывают слабыми кислотами или основаниями (или солями слабых кислот и оснований), плохо растворяются в воде, находятся в анализируемом продукте в смеси с другими веществами. В этих случаях эффективным приемом анализа служит неводное титрование.
Согласно теории Льюиса, кислотой является вещество, в молекуле которого не хватает пары электронов до устойчивой электронной оболочки и которое склонно к обобществлению свободной пары электронов основания. Следовательно, основания являются донорами, а кислоты - акцепторами пары электронов. Таким образом, реакция нейтрализации сопровождается образованием ковалентной связи за счет свободной пары электронов основания. Образование координационной ковалентной связи является первичной стадией нейтрализации, за которой может следовать диссоциация.
Одно и то же вещество в зависимости от растворителя, в котором оно растворено, может быть сильным или слабым электролитом. Сильные электролиты в водных растворах могут оказаться слабыми в неводных и наоборот.
Во многих случаях реакции нейтрализации кислот и оснований в среде различных растворителей сопровождаются образованием молекул данного растворителя. Например, в водном растворе:
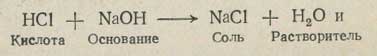
в среде жидкого аммиака:

в среде безводной уксусной кислоты:

Правильный выбор растворителя во многих случаях определяет возможность титриметрического определения того или иного вещества. Многие нерастворимые в воде соединения проявляют кислотные или основные свойства при растворении в органических растворителях. Слабые кислоты в основных растворителях ведут себя как сильные, а слабые основания ведут себя как щелочи в среде кислоты. Это общее положение позволяет правильно выбрать среду и титрант для количественного определения слабых кислот и оснований. При анализе сложных лекарственных соединений выбор растворителя и титранта зависит также от того, какая часть молекулы соединения должна вступать в химическое взаимодействие с титрантом. Во многих случаях необходимо предварительно отделить в лекарственной форме вещество от мешающих определению вспомогательных веществ (наполнителей, поверхностно-активных веществ и т. д.).
Наилучшие условия титрования слабых кислот достигаются в таких основных растворителях, как пиридин, диметилформамид, этилендиамин, бутиламин, и в их смесях с хлороформом или бензолом. К соединениям, которые могут титроваться как кислоты, относятся кислотные галогениды, ангидриды кислот, карбоновые кислоты, аминокислоты, барбитураты, ксантины, имиды, фенолы, пирролы и сульфаниламиды. В качестве титрантов обычно используют растворы метилата натрия, метилата лития, тетраэтиламмония в смесях метилового спирта с бензолом. Индикаторами служат тимоловый синий, тимолфталеин, о-нитроанилин, п-оксиазобензол. Растворы при титровании необходимо защищать от влияния углекислоты воздуха.
Для титрования слабых оснований в качестве растворителей используют ледяную уксусную кислоту, уксусный ангидрид, муравьиную кислоту, пропионовую кислоту и их смеси с бензолом или хлороформом. К соединениям, которые могут титроваться как основания, относятся амины, азотсодержащие гетероциклические соединения, оксазолины, четвертичные аммониевые соединения, щелочные соли органических кислот, некоторые соли аминов. Многие соли галогеноводородных кислот могут титроваться в уксусной кислоте или уксусном ангидриде после прибавления ацетата окисной ртути, который переводит галогенанион в недиссоциированный комплекс галогенида ртути. В качестве титрантов в этих случаях используют раствор хлорной кислоты в ледяной уксусной кислоте или диоксане; индикатор - кристаллический фиолетовый или малахитовый зеленый.
Кислоты и основания средней силы и сильные в воде можно титровать в среде кетонов, нитрилов, спиртов, гликолей.
Смеси различных кислот или оснований, а также дзуосновные кислоты и двукислотные основания по ступеням диссоциации титруют в таких дифференцирующих растворителях, как ацетон, диоксан, ацетонитрил, и их смесях с метиловым спиртом, нитробензолом, нитрометаном, метилэтилкетоном.
