Промежуточные продукты и отходы. Ферментные препараты
Амилолитические ферментные препараты
Отбор средней пробы. Среднюю пробу препарата массой не менее 1-2 кг составляют из отдельных проб, отбираемых щупом из разных мест партии. При размере партии до 10 мест (мешков) пробы в равных количествах отбирают от каждого третьего места. При более крупных партиях - до 100 мест - пробы отбирают от 10% мест, но не менее пяти проб, а в партии более чем из 100 мест - от 5% мест, но не менее 10 проб. Среднюю пробу хранят в сухой стеклянной банке с притертой пробкой.
Подготовка пробы, к анализу. Среднюю пробу препарата равномерно измельчают на лабораторной мельнице или растирают в ступке. Проход через сито с размером отверстий до 1,0 мм должен составлять не менее 95%.
Определение влажности. Навеску измельченного препарата 4-5 г, взвешенную с точностью до 0,01 г в бюксе, высушивают в сушильном шкафу при температуре 105° С в течение 4 ч. После высушивания бюкс охлаждают в эксикаторе и взвешивают. Потеря в массе, пересчитанная на 100 г препарата, является влажностью в процентах. Можно также определить влажность высушиванием в приборе Чижовой в бумажном пакетике в течение 7 мин при температуре 165-170° С. После высушивания пакетик охлаждают в эксикаторе, взвешивают и рассчитывают влажность.
Определение осахаривающей способности (ОС) (метод УкрНИИППа)
Осахаривающая способность характеризует способность амилолитических ферментов катализировать осахаривание крахмала до мальтозы. За единицу осахаривающей способности принимают такое количество фермента, которое в строго определенных условиях за 1 ч при 30° С катализирует расщепление до мальтозы 1 г растворимого крахмала (при степени гидролиза 30%). ОС препарата выражают числом указанных единиц в 1 г сухого вещества ферментного препарата или 1 мл раствора. Метод основан на гидролизе крахмала исследуемым ферментным раствором и последующем определении образовавшейся мальтозы йодометрическим методом.
Ход определения. Из тщательно измельченной воздушно-сухой средней пробы отвешивают навеску 1,00 г, переносят ее в колбу на 200-300 мл, приливают 100 мл воды и настаивают при комнатной температуре, перемешивая через каждые 10 мин. По истечении часа раствор фильтруют через складчатый бумажный фильтр. Полученный раствор служит для определения осахаривающей и мальтазной способности. В колбу на 50 мл с длинным горлышком (8-9 см) вводят пипеткой 20 мл 1%-ного буферного крахмального раствора и погружают колбу в водяную баню температурой 30° С. Через 10 мин в колбу добавляют от 1 до 10 мл исследуемого ферментного раствора и тщательно перемешивают.
Общий объем реакционной смеси должен быть 30 мл, поэтому, если для определения берут меньше 10 мл ферментного раствора, недостающий объем восполняют водой, которую вводят перед добавлением ферментного раствора. Точно через 10 мин (по секундомеру или часам с секундной стрелкой) после добавления ферментного раствора действие ферментов приостанавливают добавлением 2 мл 1 н. раствора соляной кислоты.
Содержимое колбы после осахаривания количественно переводят, смывая водой, в коническую колбу на 300-400 мл, туда же добавляют пипеткой 20 мл 0,1 н. раствора йода и сразу же 60 мл 0,1 н. раствора едкого натра или едкого кали. Щелочь приливают по каплям при перемешивании. Затем колбу накрывают часовым стеклом и отмечают время. Через 15 мин в коническую колбу добавляют 2 мл серной кислоты (1:4) и титруют избыток йода 0,1 н. раствором тиосульфата натрия.
Одновременно ставят контрольный опыт с теми же количествами всех реактивов в конической колбе, только ферментный раствор вводят после добавления 2 мл 1 и. раствора соляной кислоты (без выдержки в водяной бане). Разность между титрованием контрольного (а мл) и опытного (б мл) растворов должна составлять от 0,5 до 6 мл 0,1 н. раствора тиосульфата натрия. Если она меньше 0,5 или больше 6 мл, то определение повторяют с большим или меньшим количеством ферментного раствора.
При определении осахаривающей, амилолитической, декстринолитической, мальтазной и протеолитической способности пипетки для воды, буферного, крахмального и ферментного растворов должны иметь ватные тампоны; перед доведением до метки всех растворов (кроме 1 и. НСl и 1:4 H2SO4) внешнюю поверхность пипеток вытирают фильтровальной бумагой.
Расчет осахаривающей способности. По разности титрования контрольного (а) и опытного (б) растворов находят количество 0,1 н. раствора тиосульфата натрия (в мл), которое численно равно числу миллилитров 0,1 н. раствора йода, пошедшего на окисление мальтозы, образовавшейся в результате ферментативной реакции, а по этой величине, пользуясь табл. 12 приложения, находят ОС препарата на воздушно-сухое вещество (в пересчете на 1 г) при условии, что для определения взят 1 мл ферментного раствора в разведении 1:100. Если для определения было взято другое количество ферментного раствора или разведение его отличалось от 1:100, то величину ОС, найденную в табл. 12 приложения, пересчитывают по формуле
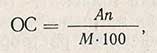
где А - ОС препарата по табл. 12 приложения; n - разведение ферментного препарата; М - количество ферментного раствора, взятое для определения, мл.
Пересчет на сухое вещество проводят по формуле
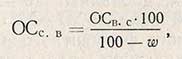
где w - влажность препарата, %.
Пример. Для определения взят 1 мл ферментного раствора в разведении 1:100. На титрование контрольного раствора (а) пошло 19,4 мл, на титрование опытного раствора (б) - 18,2 мл 0,1 н. раствора тиосульфата натрия. Разность (а - б) = 19,4 - 18,2 = 1,2 мл. По табл. 12 приложения эта величина соответствует ОС = 9,72.
Определение амилолитической способности (метод ВНИИСЛа)
Амилолитическая способность культуры плесневых грибов, выращенных поверхностным или глубинным методом, характеризует способность амилолитических ферментов катализировать расщепление крахмала до неокрашивающихся йодом декстринов. За единицу амилолитической способности принято такое количество фермента, которое катализирует расщепление 1 г растворимого крахмала до декстринов, не окрашивающихся йодом за 1 ч при температуре 30° С в строго определенных условиях концентрации крахмала и pH. Амилолитйческую способность выражают числом указанных единиц в 1 г сухого препарата (или 1 мл раствора). Выраженная таким образом амилолитическая способность показывает, сколько граммов крахмала может быть прогидролизовано до неокрашивающихся йодом декстринов 1 г препарата за 1 ч (в условиях, аналогичных условиям определения). Для определения АС проводят гидролиз 1%-ного буферного раствора крахмала раствором исследуемого препарата, отмечая время гидролиза до неокрашиваемых декстринов; конец реакции определяют пробой на йод.
Ход определения. Навеску поверхностной культуры 5,0 г тщательно растирают в фарфоровой ступке с кварцевым песком или толченым стеклом и количественно переносят в стакан или коническую колбу, добавляют 5 мл ацетатного буферного раствора (pH 4,7) и 45 мл воды. Смесь перемешивают, выдерживают при 30° С в течение 30 мин, и фильтруют. Полученный ферментный раствор используют для определения.
В коническую колбу емкостью 100 мл или широкую пробирку вводят пипеткой 25 мл 1%-ного буферного раствора крахмала, добавляют 20-23 мл воды и нагревают в водяной бане до 31-32° С, прибавляют 5-2 мл приготовленного ферментного раствора или фильтрата глубинной культуры после отделения мицелия (общий объем должен быть 50 мл) и отмечают время по секундомеру. Через каждую минуту от момента прибавления ферментного раствора стеклянной палочкой отбирают каплю жидкости и на белой фарфоровой пластинке соединяют ее с заранее нанесенной каплей рабочего раствора йода.
Реакцию расщепления крахмала считают законченной, когда йод перестанет давать изменение окраски при соединении с каплей исследуемого раствора. Время, за которое происходит расщепление крахмала до продуктов, не окрашивающихся йодом, должно быть в пределах 10-20 мин. Если оно будет больше 20 мин, то следует брать большее количество ферментного раствора, а если меньше 10 мин, то следует брать меньше ферментного раствора (1,0 или 0,5 мл). Расчет АС проводят по формуле
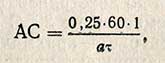
где 0,25 - количество крахмала в реакционной смеси, г; а - количество культуры гриба, введенное в реакционную смесь при определении, г воздушно-сухого препарата или мл жидкого объекта; т - время в мин, за которое произошло расщепление крахмала до неокрашиваемых йодом продуктов; 60 - пересчет на 1 ч; 1 - пересчет на 1 г воздушно-сухого препарата или 1 мл жидкого объекта.
Определение декстринолитической способности (метод ВНИИСЛа)
Декстринолитическая способность (ДС) показывает способность ферментного препарата катализировать расщепление конечных декстринов до глюкозы. За единицу ДС принимают такое количество фермента, которое катализирует расщепление 1 г конечных декстринов до глюкозы, при превращении в сахар 30% декстринов, за 1 ч в строго стандартных условиях: температура реакции 30° С; длительность проведения реакции 1 ч; активная кислотность среды (pH) 4,7; концентрация субстрата 1%; соотношение реакционных сред - субстрат 10мл и исследуемая вытяжка 5 мл.
Декстринолитическую способность выражают числом указанных единиц в 1 г ферментного препарата или 1 мл ферментного раствора. В основу определения ДС положен гидролиз конечных декстринов исследуемым ферментным препаратом с последующим определением глюкозы, образовавшейся в процессе ферментативной реакции, йодометрическим методом.
Ход определения. Взвешивают навеску 3,00 г сухой поверхностной культуры из расчета на абсолютно сухое вещество. Следовательно, если влажность культуры 10,2%, то необходимо взять навеску:
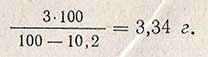
Навеску растирают в ступке с кварцевым песком (или измельченным стеклом), прибавляют 5 мл ацетатного буферного раствора (pH 4,7) и 45 мл воды. Полученную смесь перемешивают и выдерживают в термостате 30 мин при 30° С. Затем раствор отфильтровывают и полученный фильтрат ферментного раствора используют для анализа.
В две пробирки длиной 180 мм и диаметром 18 мм вводят пипеткой по 10 мл 1%-ного раствора конечных декстринов. Пробирки с раствором помещают на 10 мин в термостат температурой 30° С. Затем в пробирки вводят по 5 мл ферментного раствора, перемешивают и выдерживают смесь в термостате в течение часа при 30° С. По истечении указанного времени реакцию приостанавливают добавлением в реакционную смесь 1 мл 1 н. раствора соляной кислоты. Для определения содержания образовавшейся глюкозы содержимое пробирок количественно переносят, смывая водой, в коническую колбу на 300 мл, добавляют туда 20 мл 0,1 н. раствора йода и сразу же по каплям при перемешивании приливают 60 мл 0,1 н. раствора едкого натра или едкого кали. Колбу накрывают часовым стеклом и оставляют стоять в течение 15 мин. Затем в раствор вводят 2 мл разбавленной серной кислоты (1:4) и оттитровывают избыток йода 0,1 н. раствором тиосульфата натрия. Одновременно ставят контрольный опыт, который необходим для количественного определения сахаров в растворе конечных декстринов. Для проведения контрольного опыта в коническую колбу на 300 мл вводят 10 мл 1 %-ного раствора конечных декстринов, 1 мл 1 н. раствора соляной кислоты, 5 мл ферментного раствора. Добавляют воды до 100 мл и проводят определение сахара таким же образом, как и в исследуемом опыте.
Количество глюкозы, образовавшейся из конечных декстринов, определяют по разности в количестве тиосульфата натрия, пошедшего на титрование в контрольном и исследуемом опытах. Эта разность должна находиться в пределах 1-6 мл. Если она больше 6 или меньше 1 мл, то соответственно уменьшают или увеличивают количество препарата, взятого для анализа.
Расчет декстринолитической способности. Для вычисления ДС берут среднее значение количества тиосульфата, пошедшего на титрование двух параллельных проб. ДС вычисляют по расчетной формуле, которая составлена на основе экспериментально выявленной зависимости количества образовавшегося сахара от количества фермента, содержащегося в культуре гриба, взятой для анализа:
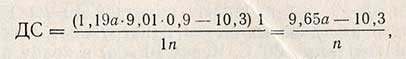
где 1,19 и 10,3 - коэффициенты, найденные экспериментально; а - разность в количестве тиосульфата натрия, пошедшем на титрование контрольной и исследуемой проб, мл; 9,01 - количество глюкозы, эквивалентное 1 мл 0,1 н. раствора йода, или 1 мл 0,1 н. раствора тиосульфата, мг; 0,9 - коэффициент пересчета глюкозы в декстрины; n - навеска культуры гриба, взятая для определения, г; 1 (в числителе) - пересчет на 1 г препарата; 1 (в знаменателе) - время действия фермента на конечные декстрины, ч.
Определение мальтазной способности (метод УкрНИИППа)
Мальтазная способность (МС) характеризует способность ферментного препарата катализировать расщепление дисахарида мальтозы до глюкозы и выражается числом единиц мальтазы в 1 г сухого препарата или 1 мл раствора. За единицу мальтазы принято такое количество фермента, которое за 1 ч при 30° С катализирует расщепление 1 г мальтозы (безводной) до глюкозы в строго определенных условиях, при степени гидролиза 30%. Метод определения МС основан на гидролизе мальтозы исследуемым ферментным препаратом с последующим йодометрическим определением образующихся сахаров.
Ход определения. В колбу на 50 мл с длинным горлышком (8-9 см) набирают пипеткой 10 мл 1%-ного буферного раствора мальтозы и погружают в водяную баню, нагретую до 30° С. Через 10 мин в колбу прибавляют от 1 до 5 мл исследуемого ферментного раствора и тщательно перемешивают. Общий объем реакционной смеси в колбе должен быть 15 мл, поэтому, если для определения берут менее 5 мл ферментного раствора, недостающий объем восполняют водой, которую вводят перед погружением колбы в водяную баню. Ровно через час после введения ферментного раствора действие его приостанавливают добавлением 2 мл 1 н. раствора НСl. Далее определяют восстанавливающие сахара йодометрически. Для этого содержимое колбочек после осахаривания количественно переводят, смывая водой, в коническую колбу на 300-400 мл и далее поступают, как и при определении осахаривающей способности.
Одновременно с опытным ставится контрольное определение, в котором к 10 мл раствора мальтозы прибавляют 2 мл 1 н. раствора НСl, а затем ферментный раствор. По разности между количеством 0,1 н. раствора тиосульфата натрия, пошедшим на титрование контрольного и опытного растворов, находят количество прогидролизованной мальтозы. Эта разность должна составлять не менее 0,5 и не более 4,4 мл. Если она менее 0,5 или более 4,4 мл, то анализ повторяют с большей или меньшей дозировкой фермента, меняя количество вводимого ферментного раствора или его разведение.
Расчет мальтазной способности. По разности между количеством 0,1 н. раствора тиосульфата натрия, пошедшим на титрование контрольного и опытного растворов, по табл. 13 приложения находят МС исследуемого объекта при условии, что для определения было взято 5 мл ферментного раствора в разведении 1:100. Если для анализа было взято не 5 мл, а другое количество ферментного раствора и разведение его отличалось от 1:100, то величину МС рассчитывают по следующей формуле:
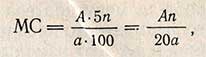
где А - величина МС, найденная по табл. 13 приложения; n - разведение; а - количество ферментного раствора, взятое для определения, мл.
Пересчет активности на сухое вещество проводится по формуле
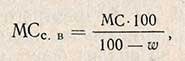
где w - влажность препарата, %.
Определение протеолитической способности (метод Лейлян-Фольгарда в модификации УкрНИИППа)
Протеолитическая способность (ПС) характеризует способность протеолитических ферментов расщеплять белок (казеин). За единицу протеолитической активности принято такое количество фермента, которое за 1 ч при температуре 30° С расщепляет 1 г казеина. Протеолитическую способность выражают числом указанных единиц в 1 г сухого препарата. При таком способе выражения ПС непосредственно показывает, сколько граммов казеина может быть прогидролизовано 1 г ферментного препарата при 30° С за 1 ч (в условиях, соответствующих условиям определения).
Для определения ПС растворенный при помощи щелочи казеин подвергают действию исследуемого ферментного раствора. После ферментативного воздействия в течение часа в опыте и перед добавлением такого же количества ферментного раствора в контроле ферментативную реакцию прерывают титрованным раствором соляной кислоты. Казеин, оставшийся нерасщепленным, количественно осаждают сернокислым натрием. Выпадая в осадок, казеин увлекает в связанном состоянии соответствующее количество соляной кислоты. Осадки отфильтровывают, а фильтраты титруют 0,1 н. раствором NaOH. Разность между количеством 0,1 н. раствора NaOH, израсходованным на титрование в опыте и в контроле, принимают за меру протеолитической способности исследуемого ферментного препарата.
Ход определения. 1 г тонко измельченной воздушно-сухой культуры заливают 50 или 100 мл воды и выдерживают 1 ч при комнатной температуре, периодически помешивая через каждые 10 мин. По истечении часа раствор фильтруют через складчатый бумажный фильтр. В колбы емкостью около 100 мл набирают пипеткой по 20 мл раствора казеина и помещают в водяную баню температурой 30° С. Через 10 мин в колбы вводят при перемешивании 10 мл ферментного раствора. Общий объем казеина и ферментного раствора должен быть равен 30 мл; если на анализ берут меньше 10 мл ферментного раствора, недостающий до 30 мл объем восполняют водой, которую вводят непосредственно перед добавлением ферментного раствора. Ровно через час в колбы прибавляют при перемешивании пипеткой 20 мл 0,1 н. раствора НСl в 7,5%-ном растворе Na2SO4 и сразу фильтруют до полной прозрачности, возвращая фильтрат на фильтр.
Контрольные пробы ставят таким же образом, только до введения ферментного раствора прибавляют раствор НСl в Na2SO4 и не выдерживают колбы на водяной бане, а сразу фильтруют. В 20 мл фильтрата контрольного и опытного определений оттитровывают избыток соляной кислоты 0,1 н. раствором NaOH в присутствии двух капель крезолкрасного (0,5%-ный спиртовой раствор) до красного окрашивания.
Разность титрований опытных и контрольных проб в мл 0,1 н. раствора NaOH, отнесенная к 10 мл фильтрата, может составлять 0,4-2,5 мл. Если она менее 0,4 или более 2,5 мл, анализ повторяют с большей или меньшей дозировкой фермента, меняя количество вводимого ферментного раствора или его разведение. По разности титрований опытной и контрольной проб, пользуясь табл. 14 приложения, находят протеолитическую способность на воздушно-сухой препарат при условии, что для определения взято 10 мл ферментного раствора в разведении 1:100. При других дозировках ферментного препарата ПС его находят по формуле
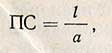
где е - число единиц, найденное по табл. 14 приложения (по результатам титрования); а - навеска ферментного препарата, соответствующая 10 мл фильтрата (1/5 от общего количества, взятого на анализ), г или мл.
Пересчет активности на сухое вещество производят по формуле
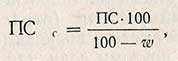
где w - влажность препарата, %.
Пектолитические ферментные препараты. Определение пектолитической способности (метод УкрНИИППа)
Пектолитическая способность (ПкС) характеризует способность ферментного препарата гидролизовать пектин. Метод основан на гидролизе пектина исследуемым ферментным препаратом с последующим контролем степени расщепления по снижению вязкости. За единицу пектолитической способности принято такое количество фермента, которое в строго определенных условиях за 10 мин при температуре 30° С катализирует гидролиз 1 г пектина со снижением вязкости раствора на 30%. Пектолитическую активность выражают числом указанных единиц в 1 г сухого ферментного препарата или 1 мл раствора.
Ход определения. Для приготовления ферментного раствора взвешивают на технических весах навеску 1,0 г воздушно-сухого препарата и переводят ее в колбу на 200-300 мл, добавляют пипеткой 100 мл воды и настаивают 1 ч при комнатной температуре, перемешивая через каждые 10 мин. По истечении часа раствор фильтруют через складчатый бумажный фильтр. При необходимости раствор перед определением разбавляют. В сухой вискозиметр системы Оствальда (водяное число при 30° С в пределах 30-40 сек) диаметром 0,8 мм, погруженный в водяную баню температурой 30° С, вводят пипеткой 10 мл 1%-ного раствора пектина. Через 5 мин вводят ферментный раствор (от 1 до 5 мл). Общий объем реакционной смеси в вискозиметре всегда должен составлять 15 мл, поэтому если для определения берут меньше 5 мл ферментного раствора, то непосредственно перед его добавлением вносят соответствующее количество воды.
После введения ферментного раствора сразу же по секундомеру отмечают время начала пектолиза и одновременно тщательно перемешивают содержимое вискозиметра воздухом при помощи груши, надетой на узкое колено вискозиметра. Точно через 10 мин после введения ферментного раствора замеряют вязкость по времени истечения реакционной смеси. Параллельно с опытом ставят и контрольное определение вязкости (времени истечения) исходного раствора пектина, которое проводят точно так, как и опытное, только ферментный раствор не добавляют, а воды вводят 5 мл. Контрольное определение проводят в том же вискозиметре или другом, водяное число которого отличается от используемого в опыте не более чем на 0,5 сек.
Расчет активности. Степень гидролиза пектина, определяемая по проценту снижения вязкости, рассчитывается по формуле
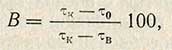
где В - снижение вязкости, %; тк - время истечения контрольного раствора пектина с водой, сек; то - время истечения опытного раствора после пектолиза, сек; тв - время истечения воды, сек.
Величина В должна находиться в пределах 20-40%.
Изменением дозировки ферментного препарата (путем варьирования концентрации ферментного раствора и количества его) добиваются получения не менее двух значений В в пределах 20-40%, одно из которых должно быть меньше 30%, а другое - больше. Полученные данные наносят на систему прямоугольных координат. По оси абсцисс откладывают количества ферментного препарата в мг, по оси ординат - снижение вязкости в %. Полученные точки соединяют прямой и интерполированием находят количество препарата в мг, которое дает снижение вязкости на 30%. Найденную величину а используют для расчета пектолитической способности по формуле
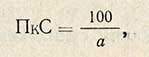
где 100 - количество пектина во взятых на пектолиз 10 мл 1%-ного раствора пектина, мг; а - найденное интерполированием количество ферментного препарата, дающее снижение вязкости раствора пектина на 30%, мг.
