Полярографические методы анализа
Полярографический метод анализа был предложен в 1922 г. чешским физико-химиком Я. Гейровским. Название метода связано с процессами поляризации, возникающими при пропускании электрического тока через растворы электролитов. Полярографический метод применим и для определения многих органических веществ, способных восстанавливаться или окисляться на поверхности электродов под действием постоянного электрического тока.
Прохождение тока через раствор электролита резко отличается от прохождения его через металл. Если к концам металлического стержня присоединить провода от источника тока, то уже при слабом напряжении через стержень будет идти поток электронов. При увеличении напряжения сила тока увеличивается равномерно и зависимость силы тока от напряжения в прямоугольной системе координат выражается прямой линией. Если же провода от источника постоянного тока опустить в раствор электролита, то электрический ток пойдет только при некоторых определенных условиях.
Прохождение тока в этом случае связано с движением ионов в растворе и с разрядом ионов на электродах или с превращением атомов электрода в ионы. На электродах начинаются химические процессы, которые приводят к изменению состава раствора или электрода. Таким образом, два одинаковых электрода становятся различными в результате прохождения тока через раствор. Эти два проводника становятся теперь различными полюсами гальванического элемента, возникающего внутри электролита; такое явление, препятствующее прохождению тока через раствор, называется поляризацией.
В полярографическом методе анализа в качестве электродов применяют ртуть. Обычно в качестве анода служит неподвижный слой ртути, налитой на дно электролизера - сосуда, в котором происходит электролиз. В качестве катода применяют капельный ртутный электрод; он представляет собой стеклянный резервуар, который с помощью каучуковой трубки соединен с капилляром, имеющим внутренний диаметр 0,03-0,05 мм.
Если приложить разность потенциалов к электродам, опущенным в раствор электролита, и постепенно увеличивать ее, то вначале ток почти не будет протекать через раствор. Только тогда, когда к электродам приложена э.д.с. определенной величины, начнется электролиз вещества. Эта величина э.д.с., при которой начинается электролиз вещества, называется потенциалом выделения или восстановления.
По достижении потенциала выделения сила тока скачкообразно увеличивается и, достигнув максимума, постепенно становится постоянной и не зависящей от дальнейшего повышения прилагаемой э.д.с. Такой ток называется предельным, или диффузионным. Возникновение предельного тока объясняется следующим образом. Во время разрядки ионов на электроде концентрация раствора в слое, прилегающем к электроду, сразу понижается и в дальнейшем пополняется за счет диффузии восстанавливающего вещества из основной массы раствора. Скорость диффузии пропорциональна разности концентраций. Как только потенциал выделения будет достигнут и, следовательно, начнется электролиз, средняя концентрация ионов у электрода уменьшится, а скорость диффузии соответственно увеличится.
При дальнейшем увеличении э.д.с. концентрация вблизи электрода практически станет равной нулю и разность концентраций будет равняться концентрации основного раствора. Поэтому скорость диффузии будет постоянной, и, следовательно, приток количества разряжающихся на электроде ионов и сила поляризационного тока также будут постоянными. Сила тока при этом уже не будет зависеть от приложенной э.д.с. Если в растворе будет присутствовать избыток какой-либо индифферентной соли, ионы которой будут переносить заряды, то предельный ток устанавливается практически только в зависимости от скорости диффузии и поэтому называется диффузионным током. Так как скорость диффузии достигает некоторого постоянного значения, которое прямо пропорционально концентрации восстанавливающего вещества в массе раствора, то диффузионный ток прямо пропорционален концентрации восстанавливающего вещества в растворе и может служить мерой его количества.
Кривая зависимости силы тока, протекающего через раствор, от напряжения между электродами называется полярографической кривой, или полярограммой (рис. 64). На оси абсцисс отложена разность потенциалов между электродами, по оси ординат - значение силы тока, протекающего через раствор. Как видно из рисунка, при малых величинах напряжения через раствор протекает чрезвычайно слабый, так называемый остаточный ток (участок от нуля до точки А). Этот ток обусловлен присутствием в растворе незначительного количества примесей, иногда растворенного кислорода, а также другими причинами. Когда будет достигнут потенциал выделения (точка А), начинается электролиз. На участке от А до В незначительное повышение разности потенциалов вызывает резкое возрастание силы протекающего через раствор тока. Дальнейшее увеличение напряжения не приводит к увеличению силы тока - участок от В до С. Этот участок характеризуется неизменностью тока в цепи при постепенном повышении разности потенциалов между электродами.
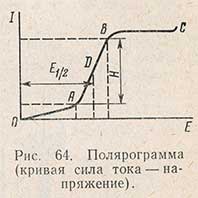
Высота волны Н характеризует предельный ток и пропорциональна концентрации растворенного исследуемого вещества. Эта пропорциональная зависимость является основой количественного полярографического анализа. Если расстояние от точки А до точки В разделить пополам и из полученной точки D опустить перпендикуляр на ось абсцисс, то он отсечет на ней определенный отрезок, характеризующий потенциал, необходимый для достижения половины предельного тока. Потенциал середины полярографической волны называют потенциалом полуволны Е1/2. Потенциал полуволны не зависит от концентрации растворенного вещества, а только от природы восстанавливающегося вещества. Поэтому он служит качественной характеристикой присутствующего в растворе вещества.
При полярографическом методе анализа в анализируемый раствор для увеличения электропроводности добавляют индифферентный электролит, разложение которого наступает при большей разности потенциалов, чем это требуется для определяемого вещества. Этот индифферентный электролит называют полярографическим фоном, или просто фоном.
Для проведения анализа полярографическим методом применяют специальные приборы - полярографы. Принципиальная схема полярографа показана на рис. 65. Анализируемый раствор находится в сосуде (электролизере) 1, на дне сосуда имеется слой ртути. Эта ртуть обычно является анодом и соединена платиновым контактом с положительным полюсом источника тока. В сосуд наливают исследуемый раствор и погружают в него толстостенную капиллярную трубку с очень малым внутренним диаметром (0,03-0,05 мм). Капилляр присоединен резиновой трубкой к резервуару 2 со ртутью, которая соединена с отрицательным полюсом источника тока. Ртуть из сосуда 2 вытекает через капилляр в исследуемый раствор отдельными каплями. Капли ртути служат катодом и на них происходит процесс электровосстановления ионов или соединений, содержащихся в растворе.
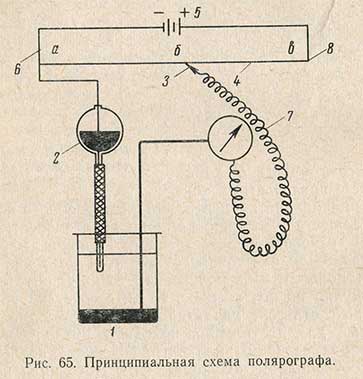
Напряжение, подаваемое на электроды, изменяют передвижением подвижного контакта 3 по проволоке 4, натянутой на мостик с делениями; концы проволоки присоединены к полюсам аккумулятора 5. Падение напряжения на проволоке пропорционально ее длине. Мостик 6 соединен с отрицательным полюсом аккумулятopa и с ртутыо, находящейся в сосуде 2. Анод (ртуть на дне стакана) соединен через гальванометр 7 с положительным полюсом аккумулятора посредством подвижного контакта 3. Если подвижный контакт совместить с началом мостика 6, то разность потенциалов между анодом и катодом электролизера будет равна нулю. По мере передвижения контакта 3 слева направо напряжение, подаваемое на электроды, увеличивается и, наконец, становится равным напряжению аккумулятора, осли контакт 3 находится в точке 8.
Гальванометр 7, включенный в так называемую малую цепь (точка 6 - электролизер - гальванометр - подвижный контакт), будет показывать силу тока, проходящего через исследуемый раствор. Напряжение на электродах определяют по положению подвижного контакта 3. Падение всего напряжения аккумулятора происходит между точками 6 и 8. Тогда падение напряжения е между аб составит
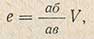
где V - напряжение аккумулятора.
Процесс полярографирования состоит в том, что подвижный контакт постепенно передвигают по проволоке от точки 6 к точке 8, рассчитывая для каждого его положения напряжение на электродах по приведенной формуле. Одновременно по гальванометру отмечают силу тока, соответствующую каждому положению контакта 3. Полученные данные наносят на график, откладывая по оси ординат силу тока в амперах или в делениях шкалы гальванометра, а по оси абсцисс - напряжение тока в вольтах или в делениях мостика. Затем точки соединяют линией и получают полярограмму.
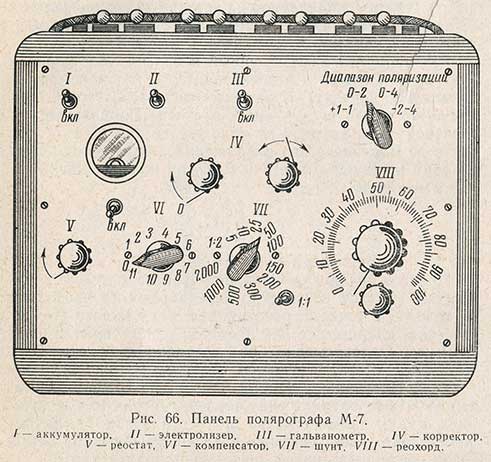
Для полярографического анализа получил распространение полярограф М-7 системы Горьковского института химии. Внешний вид (панель) этого полярографа показан на рис. 66. Электрическая аппаратура размещена в ящике полярографа, а все элементы управления прибором вынесены на панель. К клеммам полярографа приключают: аккумулятор на 4-6 в, внешний вольтметр, зеркальный гальванометр и сосуд для электролиза с капельным катодом и анодом (электролизер). Внешний вольтметр нужен только в том случае, если необходимо точно определить потенциал полуволны восстанавливающегося вещества. При обычных количественных определениях можно работать и без него.
Электролизер состоит из капельного ртутного катода, сосуда для электролиза и анода. Анод, по отношению к которому измеряют потенциал капельного катода, может быть внешним или внутренним. Внутренним анодом может служить слой ртути с большой поверхностью, который находится непосредственно в растворе электролита - фона, применяющегося при полярографировании. В качестве внешнего анода пользуются насыщенным каломельным электродом. На дно колбочки наливают слой ртути, который покрывают кашицей из каломели, и затем наливают сверху насыщенный раствор хлористого калия. В таком растворе концентрация ионов хлора постоянна, следовательно, концентрация ионов ртути также будет постоянной.
Применение внешнего каломельного электрода при полярографировании удобно в том отношении, что потенциал анода остается постоянным и не изменяется при изменении концентрации или природы фона. При полярографировании с внутренним анодом, которым служйт слой ртути на дне сосуда, потенциал анода остается постоянным только при данной концентрации и природе фона. С изменением концентрации фона и заменой одного фона другим изменяется и потенциал внутреннего анода. Поэтому при проведении качественного полярографического анализа лучше пользоваться внешним анодом. Для количественных определений можно с одинаковым успехом пользоваться как внешним, так и внутренним анодом.
На панели полярографа размещены все элементы управления прибором. В верхнем ряду помещены выключатели аккумулятора, вольтметра, гальванометра и переключатель диапазона поляризации, предназначенный для подачи на концы 6 и 8 проволоки мостика (см. рис. 65) от аккумулятора напряжения различной величины в зависимости от потенциала восстановления определяемого вещества.
Если переключатель установлен против цифр 0-2, то при совмещении подвижного контакта 3 с точкой 6 мостика разность потенциалов между капельным и каломельным электродами равна нулю, а когда подвижный контакт 3 стоит на делении 100 (т.е. в точке 8), разность потенциалов между капельным и каломельным электродами равна 2 в. Следовательно, в этом случае можно поляризовать все вещества, потенциалы восстановления которых находятся в пределах 0-2 в.
Если же переключатель поставить против делений 2-4, то при нулевом положении подвижного контакта мостика (т.е. если контакт 3 совмещен с точкой 6) разность потенциалов между капельным и каломельным электродами равна 2 в. При установке подвижного контакта на деление 100 (т.е. в точке 8) эта разность составляет 4 в. Поэтому при таком положении переключателя можно определять полярографически те вещества, потенциал восстановления которых лежит в пределах 2-4 в по отношению к насыщенному каломельному электроду. Аналогично, если переключатель находится против делений 0-4, то можно полярографировать все вещества, восстанавливающиеся при потенциалах от 0 до 4 в.
В среднем ряду панели помещены внутренний вольтметр и корректор. Корректор представляет собой электрическое устройство, служащее для вывода «зайчика» гальванометра на нулевое деление шкалы. Для пользования корректором к клеммам полярографа, находящимся с левой стороны ящика, присоединяют дополнительный аккумулятор на 2 в. «Зайчик» выводят на нулевое деление шкалы поворотом ручки корректора.
В нижнем ряду расположены переключатели и рукоятки реостата, компенсатора, шунта и мостика (реохорда). Реостат служит для подачи на концы проволоки мостика напряжения, точно равного обозначенному против переключателя диапазона поляризации. Компенсатор служит для пропускания через гальванометр небольшого тока обратного направления, компенсирующего остаточный ток, обычно протекающий через анализируемый раствор даже в том случае, если восстановление определяемого вещества еще не происходит. Форма полярографической кривой в таких случаях искажается, и определение становится затруднительным.
Шунт представляет собой систему сопротивлений, включенных параллельно гальванометру. Он снабжен переключателем и выключателем. Изменяя величину сопротивлений переключателем, пропускают через гальванометр не весь диффузионный ток, протекающий через электролизер, а только часть его. Если переключатель шунта стоит против цифры 50, это значит, что через гальванометр проходит 1/50 часть тока, протекающего через раствор. Благодаря этому с одним и тем же гальванометром полярографируют растворы различных концентраций.
Подвижный контакт 3 (см. рис. 65) выполнен на панели полярографа в виде рукоятки реохорда с указателем. Шкала реохорда имеет 100 делений. Если переключатель диапазона поляризации стоит против деления 0-2 и на концах реохорда при помощи реостата установлено напряжение, равное 2 в, то одно деление реохорда соответствует напряжению в электролизере, равному 0,02 в. При передвижении рукоятки реохорда напряжение, подаваемое на клеммы электролизера, можно увеличивать в пределах 0-2 в.
Методы определения концентрации
Для количественных определении в полярографическом методе наиболее часто применяют метод калибровочного графика и метод добавок.
Метод калибровочного графика
Этот метод заключается в том, что для определения неизвестной концентрации вещества в исследуемом растворе необходимо построить калибровочный график. Для этого готовят несколько стандартных растворов, т.е. растворов с известной концентрацией восстанавливающегося вещества, и полярографируют их при постоянной температуре и чувствительности гальванометра; концентрация «фона» в стандартных растворах также постоянна. По оси абсцисс откладывают концентрацию определяемого вещества, по оси ординат - величину диффузионного тока или высоту волны. Исследуемый раствор полярографируют в таких же условиях, как и стандартные растворы, определяют высоту волны исследуемого раствора и по графику находят соответствующую ей концентрацию.
Метод добавок
Метод применим для интервала концентраций, при котором соблюдается прямая пропорциональность между высотой волны и концентрацией восстанавливающегося вещества, что должно быть предварительно проверено. Исследование проводят следующим образом. Наливают в электролизер определенный объем исследуемого раствора и определяют длину волны. Затем добавляют определенный объем раствора с известной концентрацией (1-3 мл) и вторично полярографируют. Неизвестную концентрацию Сх определяют по формуле
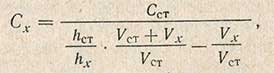
где Сcт - концентрация добавленного стандартного раствора, мг/л; Vx и Vст - объем исследуемого и добавленного стандартного раствора, мл; hx и hст - высота волны исследуемого раствора до и после добавления стандартного раствора, мм.
Определение содержания сахарозы в мелассе полярографическим методом ВНИИСЛа
Сахароза не восстанавливается на капельно-ртутном электроде. Полярографическое определение сахарозы проводят после кислотного гидролиза по количеству образовавшейся фруктозы; глюкоза не мешает определению фруктозы. Навеску мелассы 10 г растворяют в дистиллированной воде до объема 100 мл (в мерной колбе). 20 мл полученного раствора помещают в мерную колбу на 100 мл, добавляют 5 мл 10%-ной соляной кислоты и для инверсии погружают колбу на 2 мин в кипящую водяную баню. После инверсии объем гидролизата доводят до 100 мл и разбавляют еще в 10 раз.
Для полярографирования берут 10 мл окончательно разбавленного раствора, добавляют 10 мл насыщенного при комнатной температуре и отфильтрованного раствора окиси кальция (образующийся хлористый кальций служит полярографическим фоном) и снимают полярограмму в пределах э.д.с. - 1,5-1,98 в. Для вычисления результатов анализа рекомендуется составить калибровочный график по инвертированным растворам чистой сахарозы в пределах концентраций 4-6%. Обработку и подготовку этих растворов к полярографированию проводят так же, как и растворов мелассы.
Для учета количества редуцирующих веществ, содержащихся в мелассе (фруктозы, мелибиозы и восстанавливающих несахаров), полярографируют исходный раствор мелассы после 10-кратного ее разбавления, добавления 5 мл 10%-ной соляной кислоты и необходимого количества раствора окиси кальция. В этом случае рекомендуется определять высоту волны по двум показаниям гальванометра, получаемым при -1,5 и -1,95 в. Содержание сахарозы в мелассе находят по калибровочному графику, исходя из разности высот волн, полученных для растворов мелассы до и после инверсии.
Изложенный метод прост по технике выполнения, продолжительность анализа 30 мин, получаемые результаты достаточно точны. Метод пригоден для меласс с малым содержанием инвертного сахара (до 1 %) и раффинозы.
