Исследование сырья, оборудования и методы исследования
В основном бактериологический контроль на консервном предприятии сводится к исследованию сырья, оборудования и инвентаря, т. е. определению их пригодности для целей консервирования. Обычные пробы являются в принципе количественными и могут служить либо для определения специфических микроорганизмов, вызывающих порчу, либо, если дело идет о санитарных условиях на заводе вообще, для определения общего количества бактерий.
В настоящее время стандартные методы бактериологического исследования вспомогательных материалов, входящих в консервы, касаются главным образом оценки количества спор термофилов в сахаре, крахмале и специях. Такие методы, однако, могут быть легко модифицированы или приспособлены для обнаружения других групп микроорганизмов в материалах, используемых в качестве вспомогательных при консервировании. Основная трудность в бактериологическом исследовании консервного сырья состоит в том, что не существует стандартов, за исключением выработанных для спор термофилов, по которым можно было бы судить о пригодности этих материалов. Здесь имеется широкое поле для исследования. Что касается обследования оборудования и инвентаря завода, то официальные методы еще до сих пор не установлены, но вполне могут быть применены методы, предусмотренные для других целей.
Исследование сырья на присутствие спор термофилов
Сахар
Указываемый ниже способ определения термофильных бактерий в сахаре предложен Национальной ассоциацией консервщиков.
Отбор пробы. Из каждой партии отбирают пять мешков и из каждого мешка - по 0,23 кг сахара.
Приготовление образца. 20 г сахара помещают в стерильную колбу на 250 мл с меткой, указывающей объем 100 мл. Доливают стерильной водой до метки. Быстро доводят до кипячения и кипятят в течение 5 мин. или нагревают в автоклаве при 101,7° от 15 до 20 мин. Потеря воды после кипячения возмещается стерильной водой.
Споры группы возбудителей плоскокислой порчи. В пять чашек Петри наливают пипеткой по 2 мл прокипяченного раствора сахара, заливают глюкозо-триптоновым агаром и тщательно перемешивают. Чтобы предупредить рост в виде расползающихся колоний, остывшую среду заливают тонким слоем 2%-ного простого агара. Чашки ставят в термостат при 55° на 36-46 часов, затем подсчитывают общее число типичных кислотообразующих колоний на пяти чашках, которое определяет содержание спор-возбудителей плоскокислой порчи в 2 г сахара; умножением этого числа на 5 получают содержание спор в 10 г сахара. В это число не включаются колонии некислотообразующего типа.
Стандарт. При исследовании пяти образцов допускается не более 75 спор и в среднем не более 50 спор в 10 г.
Общее количество спор термофилов. В этом случае подсчитывают колонии, образующие и не образующие кислоты.
Стандарт. При исследовании пяти образцов допускается не более 150 спор и в среднем не более 125 спор на 10 г.
Споры анаэробов, не образующие H2S. 20 мл прокипяченного раствора разливают приблизительно в равных количествах в шесть пробирок с печеночным бульоном и наслаивают простым агаром. После застывания агара подогревают пробирки до 55° и инкубируют при этой температуре в течение 48 часов. Результаты выражают как число положительных и отрицательных пробирок, например:++ : ---.
Стандарт. Споры этого типа допускаются не более чем в трех (60%) образцах и для каждого образца - не более чем в четырех (65%) пробирках.
Споры бактерий, образующие H2S. 20 мл прокипяченного раствора наливают приблизительно в равных количествах в шесть пробирок с расплавленным сульфитным агаром, тщательно перемешивают и после застывания ставят в термостат при 55° на 48-72 часа. Подсчитывают типичные черные колонии и результаты выражают как число спор, содержащихся в 10 г образца.
Стандарт. Споры этого типа допускаются не более чем в двух (40%) из пяти образцов, а в каждом образце не более 5 спор в 10 г. Это равняется 2 колониям в шести пробирках.
Жиллеспи считает, что, так как термоустойчивость спор термофильных анаэробов по сравнению со спорами возбудителей плоскокислой порчи намного выше, желательно изменить американские стандарты для анаэробных спор следующим образом.
Термофильные анаэробы. Эти микроорганизмы не должны обнаруживаться ни в одной из шести пробирок (максимум 9 спор на 10 г при степени вероятности 0,025) или обнаруживаться не больше чем в одной пробирке. Они не должны обнаруживаться во всех шести пробирках дублированной серии (1/12 дает максимум 7 спор на 10 г при степени вероятности 0,025).
Споры сульфитной порчи. Не более 5 спор на 10 г сахара должны обнаруживаться стандартным методом. Временно, до изучения термоустойчивости этих спор, был заимствован американский стандарт.
Чтобы установить для термофильных анаэробов возможно более строгий стандарт, Жиллеспи предлагает следующее: высевать 5 мл 20%-ного сахарного раствора (вместо 3,33 мл, как в настоящее время), добавляя к каждым 10 пробиркам печеночный бульон. Термофильные анаэробы не должны обнаруживаться ни в одной из этих пробирок (максимум 4 споры на 10 г при степени вероятности 0,025) или, если они были обнаружены, то не более чем в одной пробирке. Они не должны обнаруживаться во всех 10 пробирках дублированной серии (1/20 дает максимум 3 споры на 10 г при степени вероятности 0,025).
Нок и Баумгартнер предложили модификацию американских методов для сахара и крахмала, а именно автоклавирование растворов в течение 30 мин. при 110° перед посевом для количественного подсчета. Жиллеспи поддерживает это предложение, так как оно дает более правильную картину заражения сахара, предназначенного для целей консервирования. В Южной Африке стандарты на сахар для консервного производства (стандартные спецификации на сахар для консервной промышленности, S. А. В. S. 420, 1952) основаны на методе Национальной консервной ассоциации, за тем исключением, что сахарные растворы нагреваются в течение 30 мин. при 110°. Иногда применяются следующие нормы.
Споры плоско кислой порчи: не более чем 10 спор на 10 г сахара.
Общее количество спор термофилов: не более 100 спор на 10 г сахара.
Термофильные газообразующие анаэробы: эти микроорганизмы должны отсутствовать во всех шести пробирках.
Споры сульфитной порчи: не более чем 1 спора на 10 г сахара.
Крахмал
Национальной консервной ассоциацией предложены следующие методы исследования и стандарты.
Подготовка пробы. 20 г крахмала помещают в сухую стерильную колбу емкостью 250 мл, добавляют стерильной холодной воды до метки (100 мл) и встряхивают. Смесь тщательно перемешивается и используется для обнаружения различных микроорганизмов-возбудителей порчи.
Споры плоскокислой порчи. 10 мл крахмальной суспензии добавляют к 100 мл растопленного декстринового агара при температуре 55-60°. Крахмальную суспензию сильно встряхивают и отбирают из нее пробу пипеткой. Крахмал добавляют к триптоновому агару, встряхивают колбу в кипящей воде в течение 3 мин. до уплотнения крахмала и затем нагревают в автоклаве в течение 10 мин. под давлением 0,35 ат. Смесь охлаждают, слегка помешивая, чтобы предотвратить аэрацию, и затем поровну распределяют на пять чашек Петри. Когда смесь затвердеет, ее заливают тонким слоем простого 2%-ного агара и помещают в термостат при 55° на 24-48 часов.
Анаэробные споры (не образующие H2S). Размещают 20 мл охлажденной суспензии крахмала примерно поровну в 6 пробирок с печеночным бульоном. Пробирки, непрерывно встряхивая, нагревают на кипящей водяной бане; желательно, чтобы на дне пробирок с печеночным бульоном оставалось небольшое количество тонко измельченной печени. Когда крахмал затвердеет, измельченная печень будет равномерно взвешена во всей среде, и это даст то преимущество, что не будет необходимости наслаивать печеночный бульон в пробирках.
Споры сульфитной порчи. Распределяют 20 мл охлажденной суспензии крахмала примерно поровну на 6 пробирок сульфитного агара. Эти пробирки также встряхивают перед нагреванием и во время нагревания на кипящей водяной бане.
В зараженных и прогретых пробирках с печеночным бульоном и сульфитным агаром важно сохранять однородную взвесь крахмала, и для этой цели необходимо часто помешивать их. Предлагается следующая методика:
1. Пробирки сразу после добавления непрогретого крахмала вращают в руках по 3 раза.
2. После помещения пробирок в водяную баню каждую пробирку вращают снова.
3. Все пробирки в бане вращают 3 или 4 раза в течение первых 5 мин. нагревания. После этого нагревание продолжают еще 10 мин.
4. Пробирки помещают в холодную воду до затвердения содержимого, затем подогревают их до 50-55° и при этой же температуре инкубируют в течение 48 часов.
Стандарты. Те же, что и для сахара.
Молочный порошок
Зеренсен (1938) рекомендует способ исследования молочного порошка на наличие спор термофилов, вызывающих плоскокислую порчу, заимствованный из методики анализов сахара, однако найдено необходимым ввести в нее некоторые изменения. Например, в качестве растворителя пользуются N/60 раствора гидроокиси натрия или лития. Это исключает трудности при подсчете на чашках, вызванные нерастворимостью, хлопьев молочного порошка и коагуляцией веществ при нагревании. Зеренсен нашел, что применение щелочного раствора также не мешает подсчету термофилов; кислотообразующие колонии при этом легче различимы, так как некоторые молочные порошки достаточно кислы, чтобы влиять на индикатор в среде, если в качестве растворителя используется вода. Чтобы избежать вспенивания, рекомендуется автоклавирование раствора молочного порошка вместо кипячения. В методике для сахара 20 г раствора доводят до объема 100 мл водой, но если готовится раствор молочного порошка, эта концентрация непригодна для подсчета на чашках. Рекомендуется брать 10 г на 93 мл воды. Методика следующая:
1. Отвешивают 10 г порошка на 93 мл стерильного раствора гидроокиси натрия или лития (N/60).
2. Энергично встряхивают раствор и автоклавируют его под давлением 0,35 ат в течение 10 мин.
3. Добавляют 1 мл автоклавированного образца в каждую из 10 чашек Петри и заливают декстрино-пептоновым агаром. Помещают в термостат при 55° на 36-48 часов.
4. Число колоний на 10 чашках принимается на общее количество термофильных спор на грамм. Число кислотообразующих колоний отмечается отдельно.
Стандарты не даются.
Специи
Методика для микробиологического исследования специй была предложена Комитетом по микробиологическим исследованиям пищевых продуктов (1943).
Отбор пробы. Рекомендуется отбирать по 50 г из каждых трех единиц упаковок.
Приготовление образца. Специи должны взвешиваться на стерильной бумаге или непосредственно в колбе с жидкостью. Вследствие различия в бактериальной обсемененности рекомендуется брать для образца следующие количества специй (в г):

К специям добавляют стерильной воды до метки (100 мл) и энергично встряхивают в течение 5 мин. Дают крупным частицам осесть и используют соответствующие разведения в различных средах.
Подсчет бактерий. Подсчет должен быть выражен количеством бактерий и спор на 1 г специй.
1. Общий подсчет бактерий: для посева используют питательный агар (Дифко) или декстрино-триптоновый агар (Дифко) и выдерживание в термостате в течение 48 час. при 37 и 55°.
2. Кислотоустойчивые бактерии и плесени: применяют сусловый агар и выдерживание в термостате при 25° или при комнатной температуре в течение 5 дней.
Для обнаружения Bacillus thermoacidurans (В. coagulans) может быть применен протеозо-пептоно-декстрозный агар. Чашки выдерживают при 37 и 55°.
3. Обнаружение спор: кипятят суспензию специй в течение 5 мин. Потеря воды при испарении возмещается стерильной водой. Чашки с соответствующим разведением заливают декстрозно-триптоновым агаром и выдерживают в термостате при 37 и 55° в течение 48 часов. Записывают общее количество спор, количество спор плоскокислой порчи и количество спор, не вызывающих эту порчу. Для обнаружения спор аэробных газообразующих бактерий применяется среда Енсена в виде измельченной ветчины и выдерживается в термостатах при 37 и 48,9° в течение 5 дней. Газообразование быстрее при более высокой температуре.
4. Обнаружение анаэробных спорообразующих форм:
а) для гнилостных анаэробов используется печеночный бульон, наслоенный агаром, и выдерживание в течение 5 дней при 37°;
б) для термофильных анаэробов, не образующих H2S, применяется печеночный бульон, наслоенный агаром, и выдерживание при 55° в течение 48 часов;
в) для термофильных анаэробов, образующих H2S, применяется расплавленный сульфитный агар и выдерживание в термостате при 55° в течение 48 часов.
Стандарты не даются.
Бактериологическое исследование завода, оборудования и прочего
Контактный чашечный метод
Простой и быстрый метод для обнаружения бактериального загрязнения плоских поверхностей описан Валтером и Хакером (1941). Этот метод пригоден для контроля эффективности чистки оборудования и инвентаря. Стерильные крышки банок, в которых ободки выравнены, асептически заполняются питательным агаром, и их держат в стерильной чашке Петри. Поверхность крышки, заполненную средой, накладывают на исследуемую поверхность на 4 сек., затем помещают в чашку Петри и инкубируют при 32°. Мерилом бактериального загрязнения является количество развившихся колоний.
Чашечный подсчет смывов
По этому методу исследуемая поверхность протирается тампоном, который затем погружают в соответствующий растворитель. Количество микроорганизмов подсчитывается чашечным методом. Тампон может быть сделан из ваты. Мы нашли, что лучше готовить его из водорослевой ваты (альгината кальция), так как он растворяется в некоторых натриевых солях. Это позволяет полностью выявить все микроорганизмы. Водорослевую бактериологическую вату описал Хиггинс.
Чашечный подсчет смывов в различных формах используется особенно широко для санитарного контроля инвентаря. Следующий метод контроля консервного оборудования основан на рекомендациях Американской ассоциации здравоохранения.
Аппараты и материалы (стерильные чашки Петри, пипетки на 1 мл, стандартный питательный агар, пинцеты или ножницы, рамки из жестяных пластинок для исследования поверхностей, стерильные ватные тампоны на стандартных деревянных палочках, посуда для тампонов). Вполне пригодной тарой являются склянки размерами 15x2 см с корковыми или резиновыми пробками. Держатели тампонов присоединяют к крышкам или пробкам, сухие тампоны помещают в стерильные пробирки или обертывают стерильной бумагой. Тампоны на деревянных держателях представляют собой плотно скрученный валик из ваты примерно 0,5 см в диаметре и длиной около 1 см.
Буферизованная дистиллированная вода для разведений готовится следующим образом: растворяют 34 г кислого фосфорнокислого калия в 500 мл дистиллированной воды, добавляют около 175 мл N раствора гидроокиси натрия и доводят объем до 1 л дистиллированной водой. Реакцию этого раствора доводят до pH 7,2 и к 1 мл раствора добавляют 800 мл кипяченой и охлажденной дистиллированной воды. Разливают разведенный раствор в сосуды для тампонов так, чтобы после автоклавирования под давлением 1 ат в течение 20 мин. в них оставалось точно 4 мл.
Сбор проб. Тампон погружают в чистый раствор. Избыток жидкости удаляют, прижимая тампон к стенке сосуда. Помещая стерильную раму на исследуемую поверхность в 25 см2, медленно и тщательно вытирают ее влажным тампоном. Образцы берутся с четырех таких площадей. После каждой пробы использованный тампон споласкивают в чистом растворе и отжимают; после того как собраны все смывы, тампоны снова помещают в сосуды.
Лабораторные методы. Палочку, на которой держится тампон, обламывают точно над ватой стерильным пинцетом или ножницами. Тампон падает в раствор, в котором вата распутывается благодаря энергичному встряхиванию. 1 мл раствора переносят в стерильную чашку Петри, добавляют 10 мл расплавленного агара, перемешивают и помещают в термостат при 32° на 48 часов. Число колоний, выросших на чашке, принимают за среднее их количество, распределенное на поверхности в 25 см2. Если исследовались отдельно четыре поверхности и на чашку высевался 1 мл раствора, а при подсчете обнаружено всего 50 колоний, записывают, что в среднем на 25 см2 поверхности приходится 50 микроорганизмов.
Вышеописанный метод может быть модифицирован для использования с тампонами из альгината кальция (водорослевой ваты) следующим образом.
Количество буферизованной дистиллированной воды в сосуде с тампонами снижается до 3,0 мл, но непосредственно перед посевом добавляют в каждый сосуд 0,9 мл стерильного раствора гексаметафосфата натрия. Встряхивают в течение 0,5-1 мин., чтобы растворить тампон. Если палочка обламывается точно над тампоном, общий объем увеличивается до 4 мл; небольшая неточность не имеет значения в подсчетах такого типа.
Американская ассоциация здравоохранения установила, что количество микроорганизмов меньшее 100 на площади в 25 см2 указывает на удовлетворительную очистку молочного оборудования; подобный стандарт дается этой ассоциацией для чашек, тарелок и пр. в пищевых предприятиях. Подробности применения метода смыва для исследования на молочном заводе опубликованы Министерством земледелия и рыбного хозяйства. По этому методу число колоний, не превышающее 5000 на квадратный фут (929 см2), указывает на удовлетворительную чистоту.
При применении соответствующей среды и температуры этот метод может быть использован для обнаружения специфических возбудителей, например спор плоскокислой порчи на консервном заводе, консервном оборудовании и пр.
Исследование тары
Эффективность мойки бутылок может быть определена стандартным методом, предложенным для молочных бутылок Американской ассоциацией здравоохранения в 1941 г. Приводим краткое описание этого метода.
20 мл стерильной водопроводной воды или буферного раствора наливают в бутылку, которая затем закрывается стерильной пробкой. Бутылку держат в горизонтальном соложении и встряхивают энергично 25 раз в направлении длинной оси бутылки с размахом 20 см. В то же самое время бутылку слегка поворачивают в конце каждого взмаха, чтобы сделать 8 полных оборотов в течение встряхивания. Если бутылки содержат остаточный хлор, следует добавить к смывной жидкости 0,5% 0,1N раствора гипосульфита натрия. После встряхивания 10 мл смывной жидкости высевают в три стерильные чашки Петри и заливают расплавленным стандартным агаром. Если бутылки сильно загрязнены, высевают на чашки 2 раза по 1 мл и 2 раза по 0,1 мл смывной жидкости. Чашки выдерживают при 32° в течение 4-8 часов. Число микробов не более 500 на бутылку емкостью в одну пинту (0,568 л) и 250 на бутылку емкостью в полпинты (0,284 л) считается Американской ассоциацией здравоохранения удовлетворительным для молочной тары.
Для исследования стеклянной тары применяется один из следующих методов: так как бутылки берут непосредственно из моечной машины, их закрывают стерильной ватной пробкой или крышкой. Небольшое количество расплавленного агара вливают в бутылку, которую затем вращают в холодной воде так, чтобы внутренняя поверхность равномерно покрылась пленкой агара. Когда среда осядет, бутылку помещают в термостат при той же температуре, что и чашки.
Банки можно исследовать по методу, принятому Американской ассоциацией здравоохранения: смывной раствор наливают в банку, накрывают сразу же стерильной крышкой и укупоривают. После перемешивания содержимого поверхность крышки стерилизуют раствором гипохлорита, прокалывают стерильным пробойником и смывной раствор высевают на чашки, пользуясь пипеткой.
Исследование воды для охлаждения банок
Для лаборатории консервного производства исследование воды для охлаждения должно рассматриваться как существенная обязательная процедура. Если вода повторно используется и хлорируется, необходимы регулярные определения как остаточного хлора, так и количества бактерий. Частота проведения таких анализов будет зависеть от типа завода и может быть установлена только опытным путем.
Определение содержания бактерий. При некоторых обстоятельствах желательно исследовать воду на специфические микроорганизмы. При контроле чистоты воды для охлаждения банок достаточно метода подсчета на чашке. При исследовании воды для питьевых целей большее значение придают подсчету микроорганизмов, выросших три 37°, чем выросших при 22°, так как первая группа относится к паразитическим типам, которая служит показателем загрязнения сточными водами или отбросами. Большинство микроорганизмов, обнаруживаемых при порче, вызванной негерметичностью тары, попадают в консервы из воды и почвы и растут лучше при 25°. Поэтому подсчет на чашках при этой температуре имеет большое значение, если это касается воды для охлаждения банок.
Образец воды должен быть взят из душа или из места втекания в тэнк, предназначенный для охлаждения. Во всех случаях воде нужно дать стечь в течение нескольких минут до отбора образца в стерильную склянку или бутылку. Если вода хлорировалась, рекомендуется добавить в бутылку до стерилизации небольшой кристалл гипосульфита натрия, чтобы удалить свободный хлор. Если вода очень загрязнена, ее разводят в отношении 1:1000 в стерильной воде. Если предполагается, что вода хорошего качества, достаточно приготовить только одно разведение 1:10. После полного перемешивания путем 25-кратного встряхивания вверх и вниз отбирают пипеткой по 1 мл от образца и от каждого разведения в две стерильные чашки Петри. В чашку наливают 10-15 мл стерильного питательного агара, охлажденного до 45°, или декcтрозо-триптонового агара, охлажденного до 45°, осторожно перемешивают быстрыми - взад и вперед, а также круговыми движениями. При этом чашки должны стоять на ровной поверхности. После застывания чашки выдерживают в термостате при 25° не менее 5 дней. Чашки, на которых выросло не более 300 колоний, отбираются для подсчета. Чашки, на которых меньше 30 колоний, не должны подсчитываться.
Если имеется заметное расхождение между двумя чашками любого разведения, правильность подсчета ставится под сомнение. Установленных стандартов на охлаждающую воду нет, но если микроорганизмов имеется меньше 100 на 1 мл, то это считается удовлетворительным. Маловероятно, чтобы использование воды такого качества давало заметную порчу, если только швы банок отвечают стандарту. Фирма, выпускающая реактив хлоротекс, прилагает карту окрашиваний, полученных при применении 5 мл реагента, растворенного в 50 мл воды. Оттенки цветов на карте соответствуют концентрациям хлора от 0,00001 до 0,0001%.
Определение содержания хлора. Содержание свободного хлора в воде для охлаждения может быть определено колориметрически.
Различные методы исследования консервов
Разведение культуры. Кроме продуктов, консервированных теплом, консервщики выпускают различные продукты с добавлением пищевых кислот, соли и сахара в разных сочетаниях. В некоторых случаях продукты под соусом или маринады подвергаются умеренной тепловой обработке, но часто остаются нестерильными, особенно в тех случаях, когда не применяется нагревание. Основная задача - определить, какие из присутствующих микроорганизмов вызывают порчу. Обнаружение роста в питательной среде мало поможет в этом отношении, разве только укажет на наличие возможных возбудителей порчи. Метод, который найден пригодным, включает постепенное разведение продукта с соответствующей питательной средой. Например, салатный крем бывает загрязнен дрожжами или кислотоустойчивыми бактериями, поэтому нужно развести 5, 10, 20 и 50% крема суслом и выдерживать смесь при 25°. Если брожение обнаруживается в самом низшем разведении, то мало гарантии, что продукт будет противостоять порче. Если для того чтобы выявить брожение необходимо значительное разведение, можно сделать вывод, что продукт умеренно устойчив к порче. Одним из методов, пригодных для испытания, является следующий.
Соответствующие разведения продукта заражаются микроорганизмом, вызывающим порчу, и результаты периодических подсчетов жизнеспособных клеток в каждой смеси наносятся на миллиметровку. Из получаемых таким образом кривых можно судить о пригодности метода.
Метод предварительного установления количественного показателя плоскокислой порчи консервированного горошка
Нок описал метод для предсказания примерного процента банок консервированного горошка, которые будут кислыми после термостатирования при 55°.
Споры, вызывающие плоскокислую порчу подсчитываются в нестерилизованных банках. По уменьшению количества спор в процессе стерилизации, которое исчисляется в десятых долях к исходному количеству, судят об эффекте стерилизации. Метод Нока применяется следующим образом:
1. Из линии отбирается непростерилизованная банка и энергично встряхивается в течение 1 мин., после чего ее вскрывают и жидкость сливают. 50 мл этой жидкости затем добавляют к 50 мл расплавленного двойной крепости декстрозо-триптонового агара в бутылке емкостью 200 мл с завинчивающейся крышкой. Горячую смесь автоклавируют в течение 10 мин. при 115°, после чего ее разливают в четыре чашки. Количество спор обозначается буквой r.
2. На кривой рис. 27 находят t - время, соответствующее десятикратному снижению количества опор для данного процесса стерилизации, включая 42% этого времени, расходуемого на подъем температуры.
3. Подсчитывают 10-t Cr, где Cr означает количество спор в нестерилизованной банке. C равняется объему жидкости в банке, деленному на 50*(5/2)*10. Множитель вводится для спор, прилипших к горошинам, множитель 10 для перевода количества микроорганизмов, выживших после тепловой обработки, указанной в п. 1, в первоначальное количество.
4. По кривой на рис. 28 подсчитывают наибольший возможный процент зараженных банок после стерилизации.
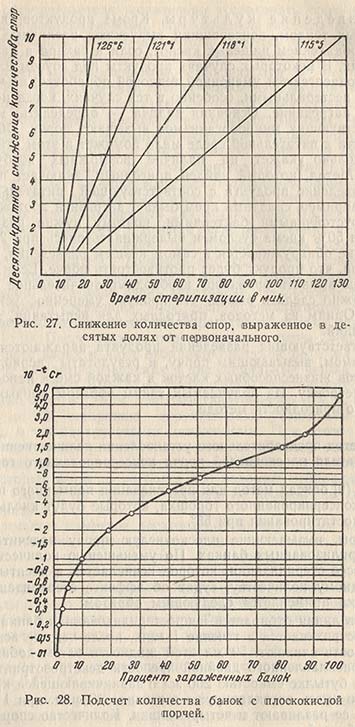
Нок обсуждает ошибки, допускаемые при работе по этому методу, тем не менее только на одном из 16 консервных заводов предполагаемые цифры плоскокислой порчи не совпадали с действительными; при этом вероятность предсказаний составляла 0,95 при инкубации 12 простерилизованных банок.
Бактериологическое исследование консервированной ветчины
Консервированная ветчина часто бывает нестерильна, поэтому в исследование этого продукта непременно включают выделение и классификацию обнаруживаемых микроорганизмов. Методика для исследования консервированной ветчины описана рядом исследователей. Техника открытия банок и отбора образцов подобна описанной ранее для других консервированных продуктов. Так как исследование направлено на идентификацию специфических микроорганизмов, включая патогенные, необходима специальная среда. Подробности можно найти в оригинальных работах.
По мнению Хоббса, патогенные микроорганизмы группы сальмонеллы и стафилококки, дающие положительную реакцию на коагуляцию, недопустимы в нормальной консервированной ветчине, даже если они выделены в небольших количествах.
Высококачественная ветчина должна быть свободна от вегетативных клеток. Допускаются только спорообразующие палочки в количестве меньше 1000 на 1 г.
