Лабораторное исследование консервов
Питательные среды
Для биологического исследования консервов в прошлом применялись специальные среды, приготовленные из продукта, подлежащего исследованию, но, как указывают Эсти и Стефенсон, а также Камерон, применение таких сред необязательно для повседневной работы. В настоящее время считается, что потребность в питательных веществах у микроорганизмов, встречающихся в консервах, может быть удовлетворена сравнительно небольшим числом легко приготовляемых сред. Следует, однако, иметь в виду, что эти среды предназначены только для выделения возбудителей порчи или их покоящихся форм. Детальное изучение специфической группы микроорганизмов требует специальных сред, в то время как для полной идентификации микроба используются стандартные среды, обычно применяемые для изучения чистой культуры. Подробные сведения по этому вопросу можно найти во многих руководствах по практической бактериологии.
Питательные среды для первоначального выделения микроорганизмов из консервов можно разделить на среды, используемые для слабокислых, умереннокислых и кислых продуктов. Под такими рубриками ниже перечисляются среды, применяемые в обычных исследованиях. Подробности о других средах для бактериологического исследования консервов даны в разделе «Дополнительные среды для обычных и специальных целей».
Обычные среды для слабокислых и умереннокислых продуктов (pH выше 4,5)
Аэробные или факультативно-анаэробные бактерии
Декстрозо-триптоновая среда. Сравнительные испытания Вильямса показали, что декстрозо-триптоновый агар является самой благоприятной средой для культивирования термофильных бактерий, вызывающих плоскокислую порчу. Эта среда пригодна также для выделения мезофильных аэробов или факультативно-анаэробных бактерий, которые могут встретиться при исследовании слабо- и умереннокислых консервов. Использование ее для выращивания культур рекомендовалось Камероном. Позднее Башфорд показал, что добавление 0,5-1% мясного экстракта значительно улучшает декстрозо-триптоновую среду. Состав среды в г следующий:

Смесь нагревают на пару до растворения. Доводят реакцию среды до pH 6,8-7,0, фильтруют и стерилизуют под давлением 1 ат в течение 20 мин. Многие исследователи рекомендуют на основании данных Винне и Фостер добавлять на каждый литр среды 1 г растворимого крахмала.
Таунсенд с сотрудниками сообщил, что одни партии бромкрезолпурпура оказывают более подавляющее действие на бактерии, чем другие; этот индикатор следует проверять перед употреблением на суспензии с известным количеством спор.
В жидкой среде образование кислоты из декстрозы микробами плоскокислой порчи вызывает изменение пурпурного цвета в желтый. На агаровой среде поверхностные колонии типичных микробов плоскокислой порчи имеют около 2-5 мм в диаметре и окружены желтой зоной с характерным непрозрачным центром. Слабые кислотообразователи могут на агаре и не образовывать желтой зоны, в то время как в жидкой среде они образуют муть со слабым изменением окраски или без изменения ее. Установлено, что не все колонии возбудителей плоскокислой порчи образуют желтую зону на триптоновом агаре. Рекомендуется уменьшить содержание триптона от 1 до 0,5%, так как это снижает буферную способность среды, и тогда большая часть культур плоскокислой порчи образует типичную желтую зону.
Среда P. Е.-2. Фолинаццо и Трой провели испытания на новой среде, предложенной Шмидтом. Среда проста в приготовлении, дешева и, по мнению многих, очень эффективна для выделения аэробов и анаэробов из консервов. Метод приготовления следующий: 12 сухих небольших горошин и примерно 20 мл 2%-ного раствора пептона помещают в пробирку размером 20x150 мм. Стерилизуют в автоклаве 15 мин. под давлением 1 ат. pH среды примерно 6,5, и дальнейшего регулирования ее не требуется.
На среде P. Е.-2 развиваются как аэробы, так и анаэробы, и поэтому в исследованиях консервов она может быть использована вместо триптонового или печеночного бульона. Однако, по наблюдениям авторов, на среде P. Е.-2 хуже выявляется рост бактерий и изменение pH, чем на триптоновом бульоне, поэтому они предпочитают для анаэробных посевов общепринятую питательную среду (триптоновый бульон).
Анаэробные бактерии
Печеночный бульон. В обычных исследованиях консервов для анаэробных бактерий применяют среду, благоприятную как для мезофилов, так и для термофилов. Из нескольких сред, рекомендованных для этой цели, наиболее широко используемой является печеночный бульон.
Приготовление печеночного бульона: 500 г мелко нарезанной говяжьей печени кипятят в 1000 мл воды в течение 1 часа. Доводят реакцию смеси до pH 7,0 и кипятят в течение 10 мин. Процеживают через ткань и доводят до объема 1000 мл. Добавляют 10 г пептона, 1 г двуфосфорнокислого калия, 1 г растворимого крахмала и доводят реакцию до pH 7,0. Когда среда готова, помещают на дно каждой пробирки кусочки печени слоем 1,25-2,5 см и наливают бульона на 2,5 см выше этого слоя. Стерилизуют 20 мин. под давлением 1 ат. Перед заражением среду прогревают в течение 20 мин. для удаления растворенного в ней воздуха. После охлаждения и заражения на поверхность среды наслаивают стерильную вазелино-парафиновую восковую смесь или стерильный 3%-ный агар, охлажденный до 50°. Амаха сообщил об успешном использовании агара, содержащего 0,2% тиогликолята натрия для наслоения на печеночный бульон.
Обычные среды для кислых продуктов (pH ниже 4,5)
Спорообразующие бактерии
На указанных средах исследуют микроорганизмы Clostridium pasteurianum и термофил В. coagulans - возбудитель плоскокислой порчи.
Протеозо-пептонокислая среда. Стерн, Хигарти и Вильямс нашли, что термофилы Bacillus thermoacidurans (В. coagulans) - возбудители плоскокислой порчи - слабо растут на большинстве сред. Для выделения и культивирования этого микроба они предлагают среду следующего состава (в г):

Смесь растворяют в воде и раствором соляной кислоты доводят pH до 5,0. В отдельном флаконе растворяют 20 г агара в 500 мл воды и затем оба раствора стерилизуют под давлением 1 ат в течение 30 мин. Перед употреблением расплавленный агар смешивают с основным раствором при 45-55°. Инкубация зараженной среды производится при 55°.
Кислая мясная среда. Линден уточняет состав кислой мясной среды для вида Cl. pasteurianum. Эта среда давала хорошие результаты при исследовании вспышек порчи консервированных ананасов и томатов кислотообразующими анаэробными микробами. Готовится она следующим образом: 500 г мяса, очищенного от жира, настаивают через ночь в 1000 мл дистиллированной воды. Кипятят 30 мин. и процеживают бульон через ткань; отжатое мясо сохраняют. Доводят объем бульона до 1000 мл, добавляют 5 г соли, кипятят в течение 10 мин. и фильтруют. Примешивают 10 г декстрозы и доводят реакцию среды до постоянного значения pH 4,5 при помощи 11 г лимонной кислоты и 12 г лимоннокислого калия (одноосновного). Бульон затем фильтруют и наливают до 10 мл бульона в пробирки, содержащие около 2 г отжатого мяса. Стерилизуют под давлением 1 ат в течение 15 мин. Непосредственно перед употреблением среду следует прокипятить, чтобы удалить кислород.
Бесспоровые кислотоустойчивые бактерии
Декстрозо-томатный бульон. Эсти и Стефенсон рекомендуют декстрозо-томатный бульон для обнаружения кислотоустойчивых бактерий. Его готовят из томатного сока и питательного бульона, взятых в равных количествах с добавлением 1% декстрозы. Эту среду можно благодаря ее кислотности стерилизовать паром при атмосферном давлении. Для получения твердой среды добавляют 3% агара и стерилизацию проводят паром в течение 1 часа. Кислая мясная среда может быть использована для культивирования большей части кислотообразующих бактерий.
Плесени и дрожжи
Среда из солодового экстракта. Линден рекомендует для дрожжей и плесеней среду из солодового экстракта. Она готовится следующим образом:
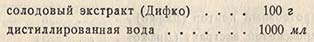
Порошкообразный солодовый экстракт растворяют на пару. Доводят реакцию до pH 4,7 и охлаждают до 50°. Добавляют небольшими порциями 100 мл 5%-ной суспензии бентонита и тщательно перемешивают; выдерживают при 50-75° в течение 30 мин., затем фильтруют через бумагу для получения прозрачного раствора. Нагревают 10 мин. при давлении пара 1 ат и фильтруют через бумагу для удаления осадка. Стерилизуют при давлении 0,7 ат 15 мин. и быстро охлаждают. Для посева на чашки добавляют 2% агара.
Декстрозо-солодовая среда. Очень хорошей средой для культивирования дрожжей, плесеней и ацидофильных бактерий является декстрозо-солодовый отвар. Его приготовляют разбавлением пивного сусла трехкратным объемом питательного бульона. Прибавляют 1% глюкозы и после доведения реакции до pH 6,0 кипятят 30 мин., фильтруют и стерилизуют под давлением 0,7 ат 20 мин. Для приготовления твердой среды необходимо прибавить 2% агара.
Дополнительные среды для обычных и специальных целей
Кукурузо-печеночная среда. Эта среда была предложена Мак-Клангом и Мак-Коем для выделения сахаролитических термофильных анаэробов и высоко оценивалась Камероном для культивирования анаэробов вообще, но Кросслей нашел, что она менее благоприятна для гнилостных типов. Приготовляют ее следующим образом.
От 1 до 2% сухой печени (печеночный бульон, высушенный при 55-60° и очищенный) и 5% кукурузной муки1 нагревают в текучем пару 1 час., охлаждают и разливают в пробирки. Эта среда довольно вязкая и требует внимания при стерилизации. Стерилизуют 2 часа при давлении 1 ат. Давление следует снижать медленно во избежание выскакивания пробок. Эта среда не требует перед заражением нагревания для удаления воздуха, и специальная анаэробная техника необязательна. Рост бактерий обнаруживается по появлению пузырьков газа, которые держатся в вязкой среде. Может выявиться также разложение печени и заметное изменение в реакции среды.
Сульфитный агар. Для обнаружения термофильных анаэробов, образующих сероводород, Камерон рекомендует среду следующего состава (в г):

Реакцию среды необязательно доводить до определенного pH. Перед розливом в каждую пробирку помещают чистый железный гвоздь. В этой среде возбудителями «сульфидной» порчи образуются характерные сферические черные круги. Газ не обнаруживается. Сахаролитические термофильные анаэробы могут вызвать общее почернение, но их легко отличить по растрескиванию агара в результате образуемого ими газа. Эта среда применяется при исследованиях консервов только в тех случаях, когда предполагается сульфидная порча.
Агар на гороховом отваре (Для накопления спор термофильных анаэробов). Мак-Кланг обратил внимание на трудность получения при анализе консервов поверхностного роста термофильных анаэробов на твердых средах. Он считает агар на отваре гороха самой благоприятной средой для этой группы, но отмечает, что наличие спор в исследуемом материале абсолютно необходимо для успешного культивирования на чашках. В опыте автора споры термофильных анаэробов часто не развивались ни в печеночном бульоне, ни на кукурузо-печеночной среде даже в старых культурах. Для получения роста на чашках следовало сперва культуры провести через полужидкую среду из агара на гороховом отваре. В этой среде спорообразование обычно происходит в течение 72 часов при 55°. С успехом поверхностные колонии затем могут быть получены на твердом гороховом агаре при использовании для посева одной петли культуры с полужидкого агара. Способ приготовления агара на гороховом отваре следующий.
а) Полужидкий агар. 30 г сухого гороха заливают на ночь 1000 мл (воды. Кипятят горох в воде в течение 2 часов и процеживают через ткань. Добавляют 5 г триптона, 7,5 г агара и 0,5 г тиогликолята натрия, кипятят 30 мин. и фильтруют до прозрачности. Разливают в пробирки и стерилизуют под давлением 1 ат в течение 20 мин. Перед употреблением среду расплавляют в кипящей воде. После охлаждения до 55° среду заражают, сильно встряхивают для равномерного распределения посевного материала и затем быстро охлаждают в воде до застывания.
б) Твердый агар. Готовится, как указано выше, но на него расходуется 15 г агара.
Среда для спорообразования аэробов. Черни, Фишер и Хигарти показали, что ионы марганца стимулируют спорообразование некоторых видов рода Bacillus. Недостачу марганца в среде можно восполнить добавлением 0,003% хлористого марганца (MnCl2 – 4H2O) к питательной среде, предназначенной для выявления спорообразования аэробных бацилл.
Пептически переваренный бульон из бычьего сердца. Трудность приготовления этой среды делает ее малопригодной для обычных целей культивирования, но Камерон считает ее очень ценной при изучении гнилостных анаэробов.
1. 1000 г обезжиренного и измельченного бычьего сердца и 1000 мл водопроводной воды медленно нагревают до кипения; доводят реакцию до pH 8,0-8,2. Охлаждают и удаляют слой жира, который всплывает на поверхность холодной среды. К 1 л отвара из бычьего сердца добавляют 2 л пептически переваренного бульона (см. п. 2). Доводят реакцию до pH 7,2-7,4.
2. 5 (или больше) больших свиных желудков чисто моют и мелко нарезают. Измельчают одинаковое количество свинины или мясной печени. Смесь составляют из 400 г измельченного свиного желудка, 400 г измельченной печени, 40 г соляной кислоты и 4 л водопроводной воды, нагретой до 50°.
Смесь хранят в стеклянной или глиняной посуде от 18 до 24 часов. Делают биуретовую и триптофановую пробы. Если обе реакции положительные, перевар становится зелено-желтоватым и содержит немного непереваренных осадков. Его переносят в большие бутыли и, нагревая на пару в течение 10 мин. при 100°, заканчивают переваривание. Перевар процеживают через ткань или оставляют его на ночь в холодильнике и декантируют после 24 часов. Фильтрат нагревают до 70° и нейтрализуют при той же температуре углекислой содой (двунормальным раствором) по лакмусу. Отфильтровывают потребное количество, добавляют 0,2% двуфосфорнокислого калия, доводят pH до 7,4 и смешивают с отваром из бычьего сердца. Доводят pH до конечной величины и стерилизуют смесь 1 час при давлении 1,2 ат. Инкубируют 5 дней и повторно стерилизуют 1 час при давлении 1,2 ат. Перед заражением .прогревают для удаления воздуха таким же образом, как и из печеночной среды. После заражения на среду наслаивают стерильную смесь из вазелина и воска.
Среда из настоя свинины и гороха. Андерсен описывает быстрый метод подсчета на чашках спор палочки ботулинус; для этого используются анаэробные чашки Петри и новая среда, обеспечивающая прорастание спор. Особенность этой среды - включение двууглекислых ионов, которые, как было показано, существенны для быстрого и постоянного развития колоний Cl. botulinum. Основная среда без добавления двууглекислого натрия вообще пригодна для накопления анаэробов. Состав ее следующий:

(Довести pH до 7,2. Количество агара снизить до 0,75% для полужидкого агара).
Автоклавируют 5 мин. под давлением 1 ат, осветляют, добавляя 25 г диатомовой земли, и фильтруют. Среду разливают в пробирки, стерилизуют 15 мин. под давлением 1 ат.
Настой свинины готовится перемешиванием измельченной свежей постной свинины в горячей дистиллированной воде (0,46 кг на 1 л) и кипячением в течение часа. Мясо отцеживают на ткань. Жир, затвердевший при охлаждении, удаляют. Для получения отвара свежий или замороженный горошек кипятят в дистиллированной воде в течение часа (равные количества гороха и воды). Осадок удаляется центрифугированием и фильтрованием с диатомовой землей.
При разливании в чашки 0,4 мл стерильного 5%-ного раствора двууглекислого натрия смешивают с 14 мл среды. Раствор двууглекислого натрия должен быть свежеприготовленным и стерилизованным фильтрацией через фильтр Зейтца.
Нитратно-сахарно-ветчинная среда. Енсен детально описывает среду для обнаружения газообразующих микроорганизмов группы Bacillus, вызывающих порчу консервированных мясных продуктов. Пробирки примерно наполовину наполняют мелко нарубленными кусочками ветчины (берут из нормальной банки) и заливают раствором, содержащим 0,4% нитрата натрия и 2% сахара. После автоклавирования под давлением 1 ат в течение 15 мин. в среде не должно быть пузырьков воздуха. Мясо должно быть покрыто на 0,6 см жидкостью.
Слой жира из кусочков ветчины предотвращает выпаривание при хранении. Среда не должна занимать больше половины объема пробирки. Инокулюм вводят на дно пробирки. Не следует допускать, чтобы после заражения оставались в пробирке пузырьки воздуха. Инкубация при 37 и 49° продолжается 48 часов. Газообразование протекает значительно быстрее при последней температуре.
«Микроветчинная» среда. Для изучения бактерий, выделенных из полуконсервированных мясных продуктов, Баттио и Биренс описали среду, аналогичную по составу консервированной ветчине. Среда включает желатин, так как Биренс показал, что некоторые виды клостридий (например, Cl. histolyticum) не образуют газа в нормальной среде, а образуют его только в среде с желатином. Состав среды в г следующий:

Смесь растворяют в водяной бане при 50° и добавляют хлористый натрий, взятый в половинной концентрации, содержащейся в ветчине (если это неизвестно, то добавляется 2% соли) pH доводят до 6,5.
15-миллиметровые кубики ветчины или мяса помещают в 16-миллиметровые пробирки с коротким кусочком железной проволоки; их автоклавируют 25 мин. при 120°. В каждую пробирку наливают 10 мл или больше желатина и все стерилизуют 15 мин. при 120°.
При употреблении добавляют к каждой пробирке стерильный раствор азотистого калия, чтобы довести конечную концентрацию до 0,05%, и добавляют 1 мл стерильного томатного экстракта.
При испытании видов клостридиум следует добавлять к среде 0,1% декстрозы. Перед употреблением среда должна быть регенерирована в кипящей бане; для наслоения на желатин используется обыкновенный 2%-ный агар.
Инкубация продолжительностью не менее 7 дней при 37° покажет газообразование у бактерий, вызвавших вздутие банок с полуконсервированными продуктами.
Осмофильная дрожжевая среда. Для обнаружения осмофильных дрожжей Логхид и Фаррелл использовали медовую среду, которая готовится следующим образом:

Смешивают ингредиенты, мед предварительно нагревают. Стерилизуют под давлением 1 ат 20 мин.; pH этой среды приблизительно 4,2.
Для выделения осмофильных дрожжей Уоллей и Скарр использовали среду следующего состава (в г):

Прочие методы исследования
Цель бактериологического исследования консервов - проверить достаточность стерилизации или определить причину порчи. При бактериологическом исследовании консервов не всегда придают достаточное значение количеству взятых для анализа образцов. При анализе на стерильность отрицательный результат одного образца не имеет значения, так как стерильные банки часто встречаются даже в недостерилизованных партиях. Кроме того, нужно понять, что отрицательные данные бактериологического исследования не являются сами по себе достаточным доказательством правильности процесса стерилизации, так как условия работы (например, начальное загрязнение) при закладке испытуемых образцов могут изменяться вследствие различных причин. Процесс стерилизации может быть оценен должным образом лишь на основе изучения теплопроводности продукта, продолжительности процесса, температурных условий и результатов стерилизации экспериментальных банок, инокулированных микроорганизмом известной термоустойчивости. Отсюда следует, что испытания на стерильность должна проводить главным образом контрольная лаборатория завода, имеющая в своем распоряжении нужное количество образцов из каждой партии.
Испытуемые банки, конечно, не должны иметь явных механических дефектов или повреждений. Недостаточное количество исследуемых образцов может привести к ошибочным заключениям также в отношении причины порчи продукта. Например, в партии консервов, испорченных в результате недостаточной стерилизации, может найтись несколько банок, которые испортились вследствие негерметичности. Если такую банку, где обнаруживаются типичные для негерметичных банок микроорганизмы (кокки, бесспоровые палочки), считать характерной для всей партии, можно сделать неверное заключение. Поэтому будет неправильно основывать заключение на результате анализа одного образца.
Прежде чем говорить о методах исследования консервов, нужно сказать, что техника вскрытия банки и отбора пробы - в значительной степени дело личного выбора. Можно воспользоваться любым методом при условии, что риск загрязнения будет сведен к минимуму. Общие указания, которые даются дальше, основаны на методах, которыми пользовались Эети и Стефенсон, Таннер и др.
Предварительный осмотр тары
Прежде всего исследуют внешний вид банки: отмечают технические дефекты шва, возможности прободения, ржавчину и другие ненормальности, которые затем увязываются с результатами бактериологического исследования.
Предварительная термостатная выдержка образцов
За исключением бомбажных банок, все образцы до высева на среды выдерживают в термостате. Микроорганизмов, не погибших при стерилизации, может быть чрезвычайно мало, поэтому цель предварительной инкубации - стимулировать размножение выживших организмов и, таким образом, обеспечить их присутствие в посевном материале. Так как сублетальное нагревание может вызвать задержку в прорастании спор, то продолжительность периода инкубации является важным фактором. Рекомендуются различные периоды - от одной до нескольких недель, но часто случается, что решающим фактором является безотлагательность исследования. Для низкокислотных и среднекислотных продуктов обычно желательна недельная инкубация (минимум) при 37°, за исключением добавочных образцов, для которых требуется более продолжительная термостатная выдержка. Ввиду того, что термофильные бактерии подвергаются быстрой автостерилизации, не следует предназначенные для исследования образцы выдерживать дольше нескольких дней при 55°. Кислые продукты полезно предварительно инкубировать при 25° в течение 10 дней. Такие продукты не следует выдерживать при более высоких температурах, так как при этом действие кислоты может настолько усилиться, что перекроет действие температуры, стимулирующее развитие микроорганизмов. Аналогичные условия даются для продуктов, содержащих такие вещества, как сернистый таз.
Техника отбора пробы
При высевах из готовых консервов главные операции, при которых возможно внести загрязнение, - это вскрытие банки, взятие пробы и посев исследуемого продукта на среду. Прежде всего все операции необходимо производить в свободном от пыли помещении. Если нет небольшого помещения, предназначенного исключительно для работы с культурами, то часть рабочего места должна быть закрыта большим навесом, под которым проводят все манипуляции. Это уменьшает возможность внесения загрязнений из воздуха. Значение загрязнения уже обсуждалось в главе XI. Здесь мы снова подчеркиваем, что необходимо соблюдать при этой работе всевозможные предосторожности.
Банка должна быть тщательно промыта горячей мыльной водой или хорошим моющим раствором. В цилиндрических банках прокол делают на крышке или на дне, в овальных банках - на корпусе, так как содержимое из них вытекает при прокалывании крышки или дна. Поверхность банки перед проколом обливают 2%-ным раствором гипохлорита натрия и оставляют его действовать примерно в течение 1 мин., сливают раствор, банку осторожно фламбируют до высушивания и покрывают стерильной чашкой Петри.
Для измерения степени разрежения в банке пользуются специальным вакуумметром. Съемный пробойник этого прибора имеет боковую трубку, набитую ватой и закрывающуюся навинчивающейся крышечкой. Пробойник, свободно обернутый ватой, вместе с резиновой присоской завертывают в плотную бумагу и стерилизуют в автоклаве. При употреблении пробойник привинчивают к вакуумметру и предварительно простерилизованную банку прижимают к резиновой присоске (рис. 24). При вращении нижней подставки донышко банки прокалывается и отмечается вакуум. После этого отвинчивают крышечку с трубки и вакуум выравнивается, причем воздух, проходя через трубку, фильтруется.

При измерении вакуума стрелка вакуумметра приводится в движение трубкой Бурдона. Значительные ошибки в отсчетах вакуума могут встретиться при некоторых обстоятельствах, например когда объем воздуха в вакуумметре сравнялся с объемом воздуха в свободном пространстве банки. Если оба эти объема известны, ошибка может быть подсчитана, но часто трудно измерить объем свободного пространства. Имеется улучшенный вакуумметр, который не требует обязательного измерения объема свободного пространства для получения настоящего вакуума. С этим вакуумметром отсчет производится после внесения известного объема воздуха из вспомогательной камеры.
Для взятия пробы банка может быть вскрыта различными способами. Вполне оправдавший себя способ заключается в том, что в банке при помощи пробойника прокалывают отверстие шириной около 12 мм. Этот метод описан у Башфорда. Пробойник состоит из стального стержня 12-20 мм в диаметре и 22 см в длину и имеет заостренный конец. На расстоянии 50 мм от кончика острия приварен круглый с загнутыми краями щиток, похожий на чашку Петри, защищающий до некоторой степени пробу от загрязнения. Пробойник перед употреблением обжигают на пламени. При проколе воздух, замещающий в банке вакуум (если измерение вакуума не производилось), стерилизуют, направляя пламя бунзеновской горелки на острие пробойника (рис. 25).

Метод взятия пробы и место, откуда она берется, варьируют в зависимости от природы продукта. Если продукт твердый, то при помощи сверла для пробок берут цилиндрик и сверло плотно затыкают стерильной ватной пробкой. Пробу из сверла удаляют палочкой. Для каждой банки требуется отдельное стерильное сверло, но палочка может употребляться одна и та же, так как она защищена от соприкосновения с пробой стерильной ватной пробкой, помещенной в сверле. При пробе на стерильность твердый продукт берут из центра банки, так как эта часть меньше подвергается тепловой обработке и, всего вероятнее, выжившие организмы находятся именно в этой части банки. Пробу переносят из сверла в широкогорлую склянку (емкостью 100 мм), содержащую около 50 мл стерильной воды и несколько кусочков битого стекла.
Продукт, содержащий жир или масло, должен быть обработан эмульгирующей жидкостью Вильямса и Кларка. Эта жидкость состоит из 2%-ного раствора смолы трагаканта и 1%-ного раствора гуммиарабика. Примерно 25 г пробы энергично встряхивают, чтобы получить, соответствующую взвесь для заражения. Суспензию стерильной пипеткой переносят в соответствующую среду.
Для приготовления суспензии наиболее удобны склянки с завинчивающимися крышками, так как их можно более энергично встряхивать. При исследовании твердого продукта нужно, чтобы взятая для анализа проба включала части из внутренних и внешних слоев продукта. При исследовании на стерильность принимается, что микроорганизмы, вероятнее всего, находятся в центре продукта, тогда как в продукте, испорченном вследствие негерметичности, они скорее сосредоточиваются на поверхности. В этом случае при взятии пробы проталкивают пробойник горизонтально и наискось в нескольких направлениях; таким образом обеспечивается уверенность в том, что материал взят также и с поверхности консерва.
При исследовании жидкого продукта или состоящего из жидкой и твердой частей жидкость берут пипеткой (20 мл) и непосредственно вносят в среду. Отверстие на кончике пипетки должно быть достаточно широким. Полутвердые и вязкие продукты удобно брать стеклянной трубкой (отверстие 4 мм).
Если требуется исследовать большое количество образцов, например при массовых анализах на стерильность, вышеуказанные методы можно несколько изменить, чтобы уменьшить потребное количество стерильных чашек Петри и пробойников. Для защиты простерилизованных донышек банок можно вместо чашек Петри пользоваться стерильными жестяными кружочками. Банки с твердым продуктом прокалывают, как указано, затем открывают их прокаленным на огне консервным ножом типа резца, стараясь не нарушить целость шва. Верхнюю часть содержимого банки удаляют прокаленным ножом; затем из центра берут пробу также прокаленным шпателем, размешивают в воде и распределяют по соответствующим средам. При исследовании жидких продуктов требуется только запас стерильных стеклянных пипеток и трубок.
Техника взятия пробы из бомбажных банок
При взятии пробы из бомбажной банки следует соблюдать некоторые предосторожности, чтобы уменьшить разбрызгивание содержимого. Прибор, предложенный Шефтелем и удовлетворяющий этому условию, состоит из большой стеклянной воронки, плотно заткнутой ватой, через которую проходит тонкий стальной стержень с заостренным концом. Вась прибор завертывают в плотную оберточную бумагу и стерилизуют под давлением. Перед употреблением воронку перевертывают над предварительно очищенной и простерилизованной банкой и острым концом стержня касаются донышка банки (рис. 26). При ударе по тупому концу стержень пробивает банку, а воронка защищает работника от брызг. Банка должна стоять на мелком подносе с раствором гипохлорита, в который стекает продукт с воронки. После выравнивания давления в банке пробу берут обычным путем.

Культивирование на средах
Приготовление культур и выбор сред зависят от цели исследования и типа исследуемого продукта. В некоторых случаях рекомендуется ставить несколько культур различного типа. Например, если требуется сократить предварительный период инкубации, то при постановке только одной культуры, возможно, не будут выделены организмы, которые находились в продукте. Для приготовления культур должно быть использовано соответствующее количество посевного материала. Как общее правило, 1 г продукта добавляется к 10 мл среды. Для руководства предлагается следующая схема постановки культур (табл. 10):
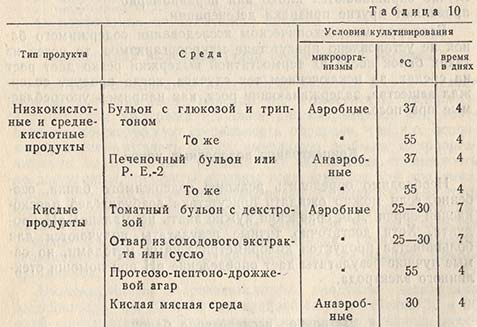
Культуры термофилов необходимо просматривать ежедневно, так как они быстро отмирают, и потому при появлении роста их немедленно подвергают дальнейшему исследованию.
При анализах на порчу приготовляют дополнительные культуры на агаровом бульоне с глюкозой и триптоном и инкубируют в течение 5 дней три 25° для выделения микроорганизмов, попавших из воздуха и воды, употребляемой для охлаждения банок.
Микроскопическое исследование продукта
После приготовления культуры мазки из содержимого банки окрашивают по методу Грама и микроскопируют. Это исследование может служить проверкой результатов, полученных при культивировании на средах, но правильное толкование микроскопического исследования иногда бывает довольно затруднительно. Выше указывалось, что нормальные, неиспорченные консервы могут содержать значительное количество мертвых микроорганизмов. Это зависит или от низкого гигиенического качества сырья или от развития микроорганизмов в период между изготовлением продукта и его термической обработкой. Случается, что посевы, приготовленные из содержимого испорченной банки, оказываются стерильными, хотя при микроскопировании и наблюдалось большое число микроорганизмов. Это зависит от автостерилизации микроорганизмов, которые в этом случае окрашиваются плохо или неравномерно и, кроме того, проявляют другие признаки дегенерации.
Если при микроскопическом исследовании содержимого банок не установлено присутствие микроорганизмов, то посев из таких банок после их термостатной выдержки резко дает рост на средах, за исключением тех случаев, когда продукт содержал вещества, задерживающие рост, как например употребляемые при посоле.
Концентрация водородных ионов
Необходимо определить реакцию содержимого банки, особенно, если можно ожидать присутствия возбудителей плоскокислой порчи. Для сравнения нужно знать нормальное pH продукта. Хотя достаточно точные результаты получаются для большинства продуктов колориметрическими методами, но самые лучшие результаты дает определение pH при помощи стеклянного электрода.
Детальное исследование банок
В заключение должно быть произведено подробное исследование банки. Описание способа вскрытия шва банки дается дальше.
Исследование продуктов в стеклянной таре
Бактериологическое исследование продуктов в стеклянной таре, подвергающихся термической обработке, в общем аналогично исследованию жестяно-баночных консервов. В этом случае взятие пробы проще, так как металлическая крышка легко снимается, но необходимо принимать меры предосторожности при выравнивании вакуума. Крышки и пробойник перед вскрытием стерилизуются обжиганием на пламени бунзеновской горелки. Эта процедура существенна для банок, укупоренных под вакуумом, и желательна даже для крышек типа феникс, укупоренных при атмосферном давлении, так как при такой укупорке часто образуется умеренный вакуум. Во избежание значения положения прокладки, что может иметь большое значение для результатов исследования, крышку снимают возможно осторожнее. При исследовании нужно обращать внимание прежде всего на следующие обстоятельства, в которых могут заключаться главные причины порчи:
1) дефекты краев банки, вследствие чего резиновая прокладка занимает неправильное положение;
2) неправильное положение бумажной прокладки: она выступает за края банки и мешает правильному положению резиновой прокладки;
3) скручивание резиновой прокладки;
4) перфорация металлической крышки.
Термостатная выдержка (тара стеклянная и жестяная)
Помимо исследования выделенных культур, всегда следует ставить дополнительные образцы на термостатную выдержку. Термостатная выдержка должна рассматриваться как контроль на коммерческую стерильность образцов, так как основная цель ее - выявить порчу, вызванную любыми микроорганизмами, находящимися в банке. Где абсолютная стерильность не достигается, продукты должны исследоваться при хранении. Кроме того, если микроорганизмы редко встречаются из-за того, что их жизнедеятельность подавлена, или по другим причинам, их можно не выявить в посевном материале, но они прорастут в конце концов в инкубированных банках. Таким образом, термостатная выдержка служит контролем на наличие микроорганизмов.
Низкокислотные и среднекислотные продукты необходимо выдерживать при 37 и 55° по крайней мере в течение 30 и 20 дней соответственно. Эти минимальные сроки в случае необходимости должны быть удлинены. После периода инкубации банки охлаждают до комнатной температуры и определяют pH и вакуум. Полезно также провести микроскопическое исследование содержимого банки, так как рост бактерий может встречаться без заметных изменений вакуума или концентрации водородных ионов. Продукты, подверженные прокисанию, можно выдерживать при 25° в течение трех месяцев. На основании определения pH таких образцов можно судить об активности микроорганизмов, вызывающих прокисание при нормальных температурах хранения.
Кислые продукты выдерживают при температуре 25° не менее 30 дней, после чего определяют вакуум. Баночные или бутылочные фрукты исследуют на признаки порчи, вызываемые Byssochlamys fulva или другими микроорганизмами. Кислые соусы, кетчупы, маринады и пр. исследуют на бродильные процессы. Газовая порча этого типа в стеклянной таре не проявляется до тех пор, пока не снята крышка, так как газ находится в растворе под давлением. В течение всего периода инкубации проводят систематическое обследование образцов и с появлением признаков порчи банки берут для детального исследования.
