Иммобилизованные ферменты
В настоящее время ферментные препараты широко применяют в пищевой и легкой промышленности. Однако использование обычных растворимых ферментов ограничено из-за относительно высокой стоимости чистых препаратов, большой лабильности и сложности отделения ферментов от реагентов и конечных продуктов реакции. Таким образом, эти дорогостоящие биологические катализаторы обычно находят однократное применение. При использовании растворимых ферментов невозможно перевести многие периодические процессы на непрерывный технологический режим, а также трудно приостановить ферментативную реакцию на нужной стадии.
Иммобилизованные ферменты сохраняют специфичность и активность типичных биокатализаторов, они более термостабильны и устойчивы к реакции среды, в которой происходит модификация субстрата, и могут быть применены в непрерывных процессах. Иммобилизованные ферменты представляют собой нерастворимые биокатализаторы, в которых фермент ковалентными связями или силами адсорбции связан с каким-либо носителем или заключен в матрицы либо микрокапсулы.
Носители для иммобилизации ферментов
К носителям предъявляются особые требования. Все они должны быть полностью нерастворимыми, отличаться высокой гндрофильностью, химической и биологической стойкостью, иметь высокую механическую прочность (несжимаемость), их физическая природа не должна вызывать сильных конформационных изменений молекулы фермента. Носители должны быть достаточно проницаемы как для самого фермента, фиксируемого по всему объему носителя, так и для соответствующих субстратов. Носители должны легко переводиться в реакционноспособную форму (активироваться) при использовании их для ковалентного связывания. Зернистые носители должны иметь однородную форму и большую удельную поверхность, что позволяет нормализовать гидродинамические свойства в установках колонного типа с иммобилизованными ферментами.
Применяемые в настоящее время носители не отвечают полностью всем перечисленным требованиям. Для получения иммобилизованных ферментов наиболее широко используются полимерные носители на основе природных (производные целлюлозы, агарозы, декстрана) и синтетических (полистирол, акриламид, нейлон, полиаминокислоты) полимеров. Следует отметить, что полимерные материалы гораздо легче подвергаются химической модификации, т. е. введению реакционноспособных группировок для ковалентного связывания ферментов. В качестве носителей применяют также пористое стекло и окисленные металлы, глины и силикагель, ткань, бумагу, пленки и др.
Природные полимеры подразделяются на две группы: полисахаридные носители и белковые носители. Синтетические полимеры классифицируются по химическому строению основной цепи макромолекулы. По этому принципу различаются полиметиленовые, полиамидные и полиэфирные носители. В качестве носителей для иммобилизации ферментов используют чаще всего природные полисахариды, затем синтетические носители полиметиленового типа, остальные типы полимеров применяют довольно редко.
В реакции с ферментами природные полисахариды, используемые для иммобилизации, сами по себе не вступают, поэтому их активируют. Гидроксильные группы полисахаридов дают возможность вводить в них различные функциональные остатки, удобные для последующего ковалентного связывания ферментов. Кроме того, природные полисахариды используют для включения ферментов в гели. Для этих целей применяют агар, который способен к образованию механически достаточно прочных гелей даже при малых концентрациях в растворе. Помимо высокой механической прочности агар устойчив к нагреванию в щелочной среде и практически нерастворим при значении pH выше 3,0. Наличие большого количества оксигрупп делает возможным иммобилизацию на агаре самых различных ферментов. Целлюлозные носители нашли широкое применение в промышленном производстве иммобилизованных ферментов. Так, в ФРГ фирма «Серва» выпускает носители под названием «Сервахром», ароматические аминогруппы у которых могут быть активированы непосредственно перед иммобилизацией фермента. Носитель марки «Сервахром» получают взаимодействием 3,3-диаминодипропиламиноагарозы с азидом n-нитробензойной кислоты и последующим восстановлением продукта реакции.
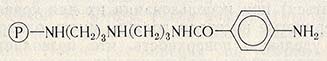
Известная английская фирма «Майлз Сервак» производит фиксированные ферменты под названием энзит (enzite). В качестве носителя используются карбоксиметилцеллюлоза и микрокристаллическая целлюлоза. Связывание ферментов осуществляется через амиды кислот или диазопроизводные.
При использовании целлюлозы и ее производных в качестве носителей были получены иммобилизованные ферменты: трипсин, папаин, химотрипсин, глюкозооксидаза, каталаза, пероксидаза, пируваткиназа, лактатдегидрогеназа, проназа, протеаза, амилаза, глюкоамилаза, аспарагиназа, фосфатаза щелочная и кислотоустойчивая, аминоацилаза, рибонуклеаза, дезоксирибонуклеаза и др.
Белковые носители содержат функциональные группы, которые используются для связывания ферментов. Коллаген в составе волокон соединительной ткани не растворяется в воде. В его составе значительное количество аспарагиновой (7%) и глутаминовой (11%) аминокислот, но относительно мало (4%) лизина. Способ иммобилизации на коллагене предусматривает электроосаждение фермента на коллагеновой пленке. Для иммобилизации могут быть применены и другие белки: эластин, глютенин (растительный белок).
Синтетические полимерные носители используются для получения ковалентно связанных иммобилизованных ферментов. Для сорбционной иммобилизации применяются в гранулированном виде микро- и макропористые материалы (сополимеры стирола, дивинилбензола, акриловой кислоты, аминокислот, нейлон и др.) с повышенной механической прочностью, стойкостью к химическим воздействиям и диаметром пор от 20 до 1000 нм. Такие носители остаются стабильными в органических растворителях - ацетоне, этаноле, этилацетате, диоксане и др.
В настоящее время английская фирма «Кох Лайт лэбораториз» выпускает в промышленном масштабе носители типа энзакрил (enzacryl), которые являются гидрофильными сополимерами акриламида и его производных и содержат функциональные группы. У носителей типа энзакрил-АА и энзакрил-АН реакционно-способной группой являются соответственно ароматические аминогруппы C6H4NH2 и гидразиновые CONHNH2-группы. Среди носителей типа энзакрил наибольший интерес с экономической точки зрения представляет энзакрил политол, который может быть регенерирован для повторного использования. Это сополимер акриламида и акрилоилцистеина, сульфгидрильные группы которого взаимодействуют с сульфгидрильными группами фермента в присутствии окислителя, например ферроцианида калия. Для регенерирования носителя связанный фермент отмывают раствором цистеина.
Для иммобилизации различных ферментов широко используется нейлон. Для связывания молекулы фермента с поверхностью носителя его гидролизуют концентрированной соляной кислотой, затем обрабатывают глутаровым альдегидом для получения активной поверхности, взаимодействующей с амино-группами фермента. Особый интерес представляет то, что в качестве носителя может применяться нейлон различной формы - в виде гранул, волокон, тканей, сеток и др. Последнее позволяет использовать этот носитель для создания проточных реактивов.
Заслуживают внимания разработки, проведенные в Таллинском политехническом институте под руководством Кестнера, по заключению фермента инвертазы в пространственную решетку полимера. Было найдено, что иммобилизация ферментов гелевидными структурами обеспечивает равномерное распределение связанного фермента в носителе и больший выход. Выделения фермента в раствор в процессе его использования обычно не наблюдалось.
Неорганические носители не подвергаются биологической атаке, химически инертны к большинству растворителей, механически прочны, имеют жесткую основу, структура которой не зависит от природы растворителя. К такому типу адсорбентов-носителей относятся каолин, кварц, диатомиты, макропористые силикагели, аэросилогели (силохромы), макропористые стекла и др. В последнее время все большее значение в качестве носителей приобретают пористые стекла. Их высокая прочность и надежность связывания ферментов открывают большие перспективы применения этого носителя для промышленной иммобилизации. Пористые стекла - сильные адсорбенты, и основная причина такой способности в том, что их макропористая поверхность состоит из силанольных (Si-ОН)-групп, которые в водных растворах имеют отрицательный заряд. Таким образом, основные и некоторые нейтральные белки сорбируются на поверхности носителя, тогда как кислые белки элюируются. Образующаяся связь между белком и матрицей бывает очень прочной, что позволяет использовать адсорбцию для иммобилизации ферментов на стекле. С применением пористых стекол были получены следующие иммобилизованные ферменты: рибонуклеаза, протеиназа, глюкозооксидаза, каталаза, пероксидаза, глюкоамилаза и др.
Методы иммобилизации ферментов
Иммобилизация ферментов может быть осуществлена двумя принципиально различными способами: без образования ковалентных связей между матрицей и белковой молекулой (физические методы иммобилизации) и с образованием ковалентной связи (химические методы).
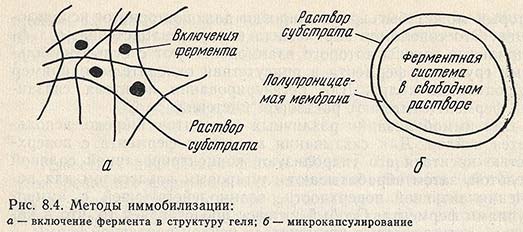
Физические методы. Для получения относительно стабильных нерастворимых форм ферментов широко используется способность белков адсорбироваться на различных поверхностях вследствие электростатических, гидрофобных и дисперсионных взаимодействий. Метод адсорбции несмотря на некоторые недостатки, связанные с легкой десорбцией ферментов, подкупает своей простотой. Существуют способы иммобилизации, при которых исключено всякое взаимодействие фермента с носителем, например метод включения. Фермент может быть заключен в поры поперечно сшитого геля совместной полимеризацией белка и мономера - включение в гель (рис. 8.4, а) или в полупроницаемую микрокапсулу - микрокапсулирование (рис. 8.4, б). Однако этот метод малопригоден в тех случаях, когда субстратами фермента являются высокомолекулярные вещества.
На нерастворимых носителях может быть осуществлена иммобилизация адсорбцией как нативных ферментов, так и предварительно модифицированных белков. В последние годы для этой цели широко применяют силикагели, стекло, целлюлозы и нейлон. Часто сорбция ферментов на ионообменниках бывает малоэффективной из-за того, что изоэлектрическая точка и оптимум каталитической активности близки. В связи с этим прочная сорбция наблюдается лишь в областях pH, где каталитическая активность мала. Чтобы преодолеть эту трудность, был предложен метод иммобилизации ферментов, предварительно модифицированных введением ионогенных групп. Модификация фермента приводит к сдвигу его изоэлектрической точки, а каталитические свойства такого фермента мало отличаются от свойств нативного. В результате модифицированный фермент достаточно хорошо сорбируется на многих ионообменниках.
При иммобилизации ферментов путем включения в гель не происходит химической модификации молекул фермента, а наблюдается простое включение их в пространственную сетку гелей. Для иммобилизации применяют такие гели: полиакриламидный, полиэтиленгликольметакрилатный, силастик, крахмальный, агаровый, гель кремниевой кислоты и др. Наиболее часто используют полиакриламидный гель. Он представляет собой гель сополимера акриламида и N,N’-бис-метилен-акриламид (сшивающий агент). Благодаря образованию поперечных связей между растущими соседними полиакриламидными цепями, возникающими в результате полимеризации винильных групп, такой гель имеет структуру трехмерной сетки.
Химические методы. Иммобилизация ферментов путем образования новых ковалентных связей является в настоящее время доминирующим способом получения биокатализаторов пролонгированного действия. Преимущество этого способа в том, что фермент, как правило, не переходит в раствор даже при очень длительном использовании.
Химическая иммобилизация ферментов может быть осуществлена как на полимерном носителе, так и за счет поперечной сшивки молекул белка без использования носителя. Последняя позволяет получать обычно нерастворимые препараты с высокой удельной, активностью, однако технологические свойства делают их малоперспективными для практического использования. Метод образования ковалентной связи между носителем и белком обычно классифицируют по типу происходящей при этом химической реакции.
Наиболее часто используемыми при получении иммобилизованных ферментов являются реакции ацилирования и аминоацилирования, алкилировання, азосочетания, образования иминов и в меньшей степени - окислительно-восстановительные и радикальные.
Сложность строения белков и разнообразие молекулярных взаимодействий, проявляющихся при построении молекулы фермента, требуют индивидуального подхода к иммобилизации каждого отдельного фермента.
Наряду с иммобилизацией ферментов возможна также иммобилизация целых клеток микроорганизмов. Среди различных матриц для иммобилизации клеток микроорганизмов наиболее подходящими являются полимеры - производные акриловой кислоты. Они механически устойчивы и инертны к разложению под действием микроорганизмов. Метод основан на механическом заключении клеток в пространственную решетку полимера.
Иммобилизованные клетки уже применяются для осуществления процессов трансформации органических соединений, например для разделения рацемических смесей на оптические изомеры, инверсии сахарозы, дегидрирования, восстановления и гидроксилирования стероидных соединений и других процессов.
При иммобилизации, как правило, наблюдаемая каталитическая активность ферментов уменьшается. Это явление обусловлено рядом причин:
1) в результате иммобилизации может нарушиться целостность вторичной, третичной и четвертичной структур фермента;
2) при больших степенях заполнения поверхности носителя инактивация фермента может быть вызвана белок-белковыми взаимодействиями;
3) при химических методах иммобилизации происходит модификация молекулы фермента, что также может привести к уменьшению его активности;
4) при иммобилизации может произойти изменение микроокружения фермента, что оказывает влияние как на собственную его реакционную способность, так и на локальную концентрацию различных веществ, принимающих участие в ферментативном процессе (ионов водорода, субстратов, кофакторов, эффекторов);
5) при реакции иммобилизованного фермента с высокомолекулярными субстратами могут иметь место стерические затруднения для подхода к молекуле биокатализатора, обусловленные носителем.
Несмотря на все сказанное в большинстве случаев иммобилизация приводит к стабилизации ферментов. В результате химического присоединения к носителям возрастает термостабильность некоторых ферментов. Так как это явление характерно для различных ферментов при использовании разнообразных носителей и методов пришивки, полагают, что главной причиной стабилизации является образование связей между ферментом и носителем. Чем больше образовано связей между ферментом и носителем, не затрагивающих активного центра, тем выше стабильность. В этом случае происходит фиксация каталитически активной конформации фермента, препятствующей разворачиванию ферментной глобулы, т. е. денатурации.
Большинство ферментов теряет каталитическую активность под действием так называемых денатурирующих агентов, а также при резком отклонении pH среды от оптимума. Полагают, что механизм стабилизации ферментов в результате пришивки против термоинактивации и против инактивации под действием денатурирующих агентов одинаков и обусловлен повышением жесткости молекул.
При иммобилизации в пористых носителях ферменты становятся недоступными для действия микроорганизмов ввиду того, что размеры пор носителя меньше размеров микроорганизмов.
Важной характеристикой иммобилизованных ферментов является их стабильность при хранении.
