Природа ферментов и механизм их действия
Обладая микроскопически малыми размерами и почти беспредельной при благоприятных условиях способностью к размножению, микроорганизмы, кроме того, проявляют еще и необычную реакционную способность. В живой микробной клетке протекает множество разнообразных, очень сложных химических реакций: синтеза, расщепления, окисления и восстановления.
Химику для воспроизведения этих реакций в лабораторных условиях были бы необходимы сложнейшие приборы, сильные реактивы (концентрированные кислоты и щелочи), высокие и низкие температуры, высокие давления и вакуумы, специфические методики (которые в настоящее время только еще начинают разрабатываться - например, для синтеза сложных белков). В живом же организме все эти процессы протекают в строгой последовательности, быстро, регулярно и согласованно, в очень мягких условиях - при нормальных температурах и давлениях. Объясняется это тем, что в живых клетках вырабатываются особые вещества - биокатализаторы, обусловливающие гладкое протекание огромного числа химических процессов, связанных с обменом веществ. Эти биокатализаторы называются ферментами или энзимами.
Слово «фермент» происходит от латинского слова «ферментум» (fermentum) - закваска, слово «энзим» - от двух греческих слов: «ен» - внутри и «циме» (zyme) - закваска. Этими словами в XV-XVI вв. характеризовали неясные тогда процессы подъема теста, квашения капусты, скисания молока, превращения плодово-ягодных соков в вино и процессы получения кваса, браги, уксуса и пр.
Препаративные работы по выделению ферментов в чистом виде, выяснению их химического строения и механизма действия сделались возможными только благодаря успехам коллоидной и белковой химии. Выделением и изучением ферментов занималась большая плеяда ученых многих стран, в том числе и выдающиеся русские исследователи. В 1814 г. академик Российской академии наук К. С. Кирхгоф открыл важную ферментативную реакцию - осахаривание крахмала под действием ячменного солода, а в 1833 г. был выделен в относительно чистом виде и фермент, вызывающий эту реакцию, получивший название диастаза (а затем амилазы). В 1862 г. русский биохимик Н. Лясковский высказал мысль о белковой природе ферментов. Открытия Кирхгофа и высказывания Лясковского положили начало развитию науки о ферментах. В настоящее время изучением роли ферментов, их строения, химизма и механизма биохимических реакций в живой природе занимается биохимия.
Брожение как процесс, в котором наглядно проявляется действие ферментов, особенно привлекало к себе внимание исследователей. Попытки осуществить его без дрожжей долгое время терпели неудачу. Лишь в 1871-1872 гг. русской исследовательнице М. М. Манассеиной удалось получить дрожжевой сок, который, несмотря на отсутствие в нем живых дрожжей, обладал способностью вызывать брожение сахарсодержащих сред. Растерев дрожжи с измельченным горным хрусталем и профильтровав полужидкую массу через мелкопористые фильтры, задерживающие и живые и мертвые клетки, Манассеина впервые получила бродильные ферменты, играющие роль катализаторов в спиртовом брожении. Спустя 25 лет, в 1897 г., исследования Манассеиной были подтверждены немецкими учеными - братьями Бухнер.
В основу современного понимания природы и действия ферментов положена теория академика А. И. Опарина, согласно которой в живом организме один и тот же фермент может находиться частично в свободном, а частично в связанном состоянии. Ферменты, находящиеся в свободном состоянии (растворенные в клеточном соке - экзоферменты), могут быть свободно выделены клеткой в окружающую среду, где и проявляют свое ферментативное действие. Связанные ферменты, адсорбированные клеточными структурами и входящие в состав цитоплазмы клеток, эндоферменты - проявляют свое действие лишь внутри живых клеток и в окружающий субстрат ими не выделяются.
Количество ферментов в живой клетке ничтожно мало, однако результат их действия очень велик - за короткий промежуток времени они могут вызвать превращение громадного количества вещества. В химической лаборатории для расщепления белка до аминокислот его надо кипятить с крепкой (25%-ной) серной кислотой примерно в течение суток. Фермент же, вызывающий расщепление белков (трипсин), осуществляет эту реакцию в течение всего нескольких часов при температуре около 37 °С, причем для протекания реакции требуется ничтожное количество фермента. 1 г инвертазы, например, вызывает инверсию 200 кг сахара; 1 г сычужного фермента (химозина) способствует свертыванию около 880 л молока; 1 г амилазы при определенных условиях может вызвать осахаривание 1 т крахмала и т.д.
По характеру своего действия ферменты могут быть сравнимы с неорганическими катализаторами. Ферменты, как и неорганические катализаторы, не создают новых реакций, а только ускоряют существующие. Так же, как неорганические катализаторы, они не расходуются во время процесса, не теряют своих первоначальных свойств, не входят в состав образующихся конечных продуктов. (Временно ферменты могут входить в состав промежуточных продуктов реакции). Однако существенным отличием ферментов от неорганических катализаторов являются следующие признаки.
а) Специфичность их действия. Каждый фермент может действовать только на определенную группу веществ, ускорять только одни определенные реакции. При помощи одних и тех же кислот (например, соляной) можно расщепить жиры, а также белки и углеводы. Ферменты же, разлагающие белки, не действуют ни на углеводы, ни на жиры. То же относится к ферментам, расщепляющим углеводы и жиры.
Большинство ферментов обладает ясно выраженным и обычно полным избирательным сродством к одному только оптическому изомеру и совершенно не затрагивает другой. По образному сравнению Фишера, фермент должен подходить к веществу, как ключ к замку. Фермент лактаза гидролизует только лактозу, но совершенно не действует на родственные дисахариды (мальтозу, сахарозу или целлобиозу). Амилаза вызывает расщепление только крахмала, а каталаза - перекиси водорода и пр. Эта специфичность действия ферментов является результатом структурных особенностей как среды, в которой они действуют, так и самого фермента.
б) Малая устойчивость к внешним воздействиям. Как вещества белковой природы, ферменты теряют свою активность уже при температуре 60-70 °С, а при 100°С разрушаются. На неорганические катализаторы такая температура никакого влияния не оказывает. Высокая кислотность или щелочность среды, наличие тяжелых металлов, танина также снижает активность ферментов. Эта неустойчивость (лабильность) ферментов по отношению к неблагоприятным условиям среды является весьма характерной.
в) Сложность химического строения. Химическая природа большинства ферментов детально установлена только в последние годы. На основании химического строения ферменты были разделены на однокомпонентные, представляющие собой простые белки, и двухкомпонентные - сложные белки, содержащие наряду с белковой частью молекулы и небелковый компонент. Небелковая часть двухкомпонентного фермента получила название активной или простетической групы. Простетическая группа может быть прочно соединена с белковой частью фермента или, наоборот, может легко отделяться. В этом случае она называется коферментом.
В двухкомпонентных ферментах в качестве активной группы обычно выступают либо витамины, либо соединения типа аденина, флавина, пиридина и пр. Аденин - кристаллическое вещество с температурой плавления около 360 °С, обладает сильными основными свойствами, образуется при гидролизе нуклеиновых кислот. Рибофлавин (от латинского flavus - желтый) - желто-зеленый, растворимый в воде пигмент. Пиридин - бесцветная жидкость с характерным неприятным запахом и температурой кипения 115 °С. Производные пиридина, в частности карбоновые кислоты, входят в состав витаминов группы В.
Белковая часть молекулы фермента состоит из специфического белка, образуемого живой клеткой за счет собственной цитоплазмы. Активные группы, как правило, образуются за счет ядерного вещества клеток.
Являясь белковыми веществами, ферменты, естественно, обладают и свойствами белков: они дают характерные цветные реакции на белки (биуретовую, ксантопротеиновую и пр.), свертываются при кипячении (термолабильны), осаждаются из водных растворов спиртом, ацетоном; высокие концентрации солей тяжелых металлов и формальдегид парализуют их активность и пр.
Каталитическое действие фермента обусловлено теми химическими реакциями, которые присущи его активной группе,
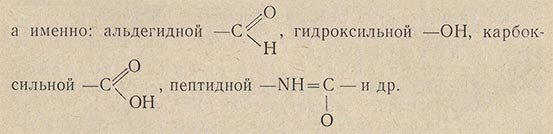
Белковая часть фермента также участвует в ферментативных превращениях, вступая во взаимодействие с соединениями, вовлеченными в ферментативную реакцию. Однако белковая часть фермента в отличие от его активной группы проявляет большую специфичность - она вступает во взаимодействие только с определенными соединениями. Эта специфичность белковой части обусловливает специфичность фермента в целом и проявляется как способность фермента действовать лишь на определенные химические вещества.
Наиболее характерными химическими реакциями при ферментативном процессе являются: гидролиз, омыление эфиров, гидрирование и дегидрирование, окисление и восстановление и пр.
