Определение окислительно-восстановительного потенциала
Окислительно-восстановительным потенциалом (сокращенно ОВ-потенциалом) для раствора называют разность потенциалов, которая возникает между платиновым электродом, погруженным в этот раствор, и нормальным водородным электродом при условии, что эти два электрода составляют гальванический элемент. ОВ-потенциал обозначают символом Eh и выражают в вольтах. Окислительно-восстановительный потенциал (ОВП) является показателем окислительно-восстановительной способности раствора и характеризует направленность протекающих в нем окислительно-восстановительных процессов.
Вода, как известно, в очень небольшой степени подвергается электролитической диссоциации по уравнению
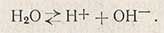
Наряду с электролитической диссоциацией происходит и частичная диссоциация воды по уравнению
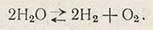
Следовательно, кроме ионов водорода и гидроксила, вода всегда содержит и небольшое количество водорода и кислорода, причем соотношение их вполне определенно. В водных растворах это соотношение нарушается: если в растворе содержится восстановитель, то восстанавливающего водорода будет больше, а окисляющего кислорода меньше, чем в чистой воде; при наличии в воде окислителей концентрация водорода будет меньше, а кислорода больше, чем в чистой воде.
Следовательно, восстановительную способность раствора можно выразить концентрацией в нем водорода [H2], а окислительную - концентрацией кислорода [O2]. Величины [Н2] и [O2] связаны константой диссоциации:
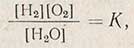
значение которой является величиной постоянной.
Увеличение концентрации водорода [Н2] сопровождается уменьшением концентрации кислорода [O2], и наоборот. Поэтому возможно восстановительную и окислительную способность раствора охарактеризовать величиной концентрации водорода [Н2], подобно тому как кислотность и щелочность выражают величиной концентрации водородных ионов (Н+).
Ввиду того что величина концентрации водорода в растворе очень мала, принято выражать ее через десятичный логарифм с обратным знаком, обозначаемый rН2, т.е. rH2 = -lg[Н2]. Значение гН2 может изменяться от нуля до 42,6. Чем меньше значение rH2, тем больше восстанавливающая способность раствора.
Величина ОВ-потенциала зависит от концентрации водорода [Н2], т.е. от величины rН2, и от концентрации водородных ионов (pH). Зависимость этих величин (rН2, pH и Eh) выражается формулой
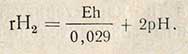
Окислительно-восстановительный потенциал можно определить потенциометрическим и колориметрическим методами. Определение ОВ-потенциала потенциометрическим методом основано на определении э.д.с. гальванического элемента, в котором в качестве одного полуэлемента взят гладкий платиновый электрод, погруженный в исследуемый раствор, а в качестве другого полуэлемента - насыщенный каломельный электрод. В таком элементе насыщенный каломельный электрод при данной температуре имеет постоянный потенциал и э.д.с. элемента будет изменять свое значение в зависимости от потенциала полуэлемента, состоящего из гладкого платинового электрода, погруженного в исследуемую жидкость. Потенциал же этого полуэлемента изменяется в зависимости от хода окислительно-восстановительных реакций в исследуемом растворе. Определение следует проводить в атмосфере углекислого газа.
Можно определять ОВ-потенциал, пользуясь лабораторным рН-метром ЛП-58. Измерение проводят с платиновым электродом аналогично определению pH (пш), но в исследуемый раствор не добавляют хингидрон. Величину Eh определяют при этом в милливольтах непосредственно по шкале прибора.
Колориметрический метод
В основе колориметрического метода лежит изменение окраски индикаторов в зависимости от величины Eh. По интенсивности окрашивания исследуемого раствора при добавлении к нему того или другого индикатора судят о величине Eh. В качестве индикаторов применяют красители: 2,6-дихлорфенолиндофенол, 2,6-дибромфенолиндофенол, 2,6-дихлорбензоиндофенол и другие.
В контроле пивоваренного производства Н. И. Булгаков рекомендует проводить определение Eh с применением индикатора 2,6-дихлорфенолиндофенола. Сущность предлагаемого метода состоит в определении времени (в секундах), необходимого для обесцвечивания раствора указанного индикатора на 80% за счет редуцирующих веществ, содержащихся в исследуемом растворе. Для проведения определения необходимо следующее.
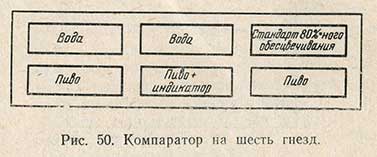
1. Аппаратура. Компаратор на шесть гнезд с задней стенкой из матового стекла (рис. 50); четырехугольные склянки из бесцветного стекла с параллельными стенками емкостью 50 мл; пипетки на 2 мл; пипетки с делением 0,1 мл; секундомер.
2. Растворы: 1) 0,005-молярный раствор 2,6-дихлорфенолиндофенола; 2) буферные растворы, имеющие pH сусла и пива; 3) стандарт 80%-ного обесцвечивания. Этот стандарт готовят в одной из четырехугольных склянок путем добавления к 40 мл одного из буферных растворов 0,2 мл 2,6-дихлорфенолиндофенола.
Для анализа пива применяют буферный раствор с значением pH, равным 4,4. В случае резкого отклонения величины pH исследуемого пива от указанного (на 0,2 и больше) надо брать буферный раствор, имеющий другое значение pH. При исследовании пивного сусла следует брать буферные растворы с значением pH 5,6-6. Раствор 2,6-дихлорфенолиндофенола и стандарт 80%-ного обесцвечивания имеют ограниченную стойкость, поэтому раствор индикатора готовят каждые 6 дней и хранят в темной склянке; стандарт 80%-ного обесцвечивания готовят только на один день работы.
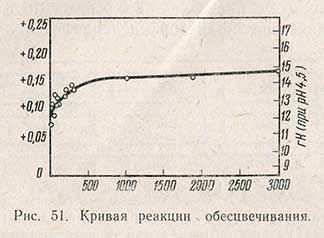
В четырехугольные склянки наливают в левый ряд воду и исследуемую жидкость (пиво, сусло и др.), в правый ряд - стандарт 80%-ного обесцвечивания и исследуемую жидкость, в средний ряд - воду и исследуемую жидкость, к которой добавляют 1 мл раствора индикатора. Все жидкости берут в объеме 40 мл. Сразу же после добавления индикатора содержимое склянки закупоривают пробкой, перемешивают, включают секундомер и склянку ставят на место в компаратор. Отмечают время, по истечении которого окраска в среднем ряду склянок сравняется с окраской в правом ряду. Это время в секундах выражает величину реакции обесцвечивания. Левый ряд бесцветный и служит лишь для более легкого улавливания изменения окраски. На рис. 51 приведена кривая, связывающая величину реакции обесцвечивания с гН2 и Eh.
